Actualizado 24 diciembre 2023
Introducción
Definición:
Gasto cardíaco inadecuado para la demanda tisular, debido a una disminución del volumen sanguíneo circulante (volemia).
La disminución progresiva del volumen sanguíneo reduce las presiones de llenado cardíaco, reduciendo el volumen sistólico, que, al menos inicialmente, se compensa con taquicardia.
El bajo volumen sistólico llega a un punto que ya no se compensa con taquicardia, lo que produce una reducción absoluta del gasto cardíaco y una hipoperfusión tisular.
De forma compensatoria, los tejidos aumentan la extracción de oxígeno (tasa de extracción de oxígeno), aumentando la diferencia entre el contenido de oxígeno arterial y venoso (Ca-v) y disminuyendo la saturación venosa mixta (SvO2).
Clínica:
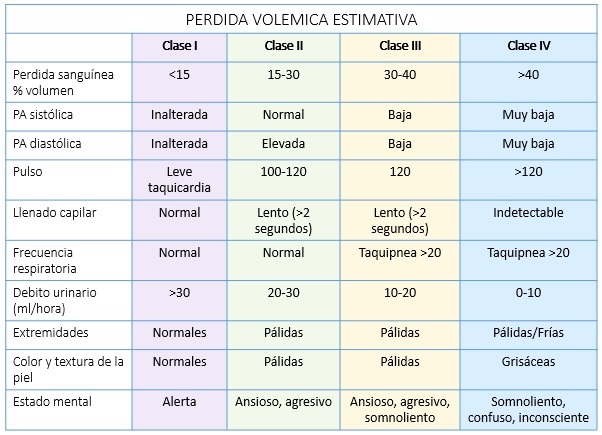
- Disminución del nivel de conciencia.
- Confusión.
- Agitación.
- Hipotensión arterial,
- Perfusión capilar periférica lenta.
- Extremidades frías.
- Aumento de lactato (> 2 milimoles/L).
- Taquidisnea.
- Hipoxia.
- Oliguria.
- Azoemia.
- Piel fría y pegajosa.
- Hipomotilidad gastrointestinal.
- Pérdida de la función hepática.
- Vena cava inferior colapsada.
- PVC baja (< 8 mmHg).
Status hemodinámico: El gasto cardíaco se mantiene inalterado, mientras la resistencia vascular periférica está elevada. Por otra parte la La presión en cuña de la arteria pulmonar es normal y la SvO2 es > 65%.
A medida que la afección empeora y aumenta la gravedad del shock, se produce una caída en el gasto cardíaco, la presión en cuña de la arteria pulmonar y la SvO2 .
Causas:
- Hemorragia.
- Deshidración.
- Secuestro de líquidos al tercer espacio.
Reposición volémica en el shock
Principios de reposición volémica
Debería ser la primera intervención realizada en un paciente en shock, con el objetivo de elevar el DO2 (aporte de oxigeno) aumentando la precarga y, en consecuencia, el gasto cardíaco.
La reposición de volumen debe ser rápida para evitar el deterioro de la afección con isquemia generalizada y disfunción multiorgánica.
Capacidad de respuesta al volumen: La evaluación de la capacidad de respuesta a la reposición de volumen se puede realizar mediante medidas estáticas, como la presión venosa central (PVC) y la presión de oclusión de la arteria pulmonar (PCAP), sin embargo, no son confiables para dicha evaluación y cada vez se desaconseja su uso.
Por lo tanto, se prefiere utilizar índices dinámicos, como la variación de la presión del pulso (VPP) y la variación del volumen sistólico (VVS), que utilizan la interacción cardiopulmonar en pacientes con ventilación mecánica, a través del análisis de la curva de onda de pulso para determinar la capacidad de respuesta al volumen, con buena precisión. .
Además de esto, la evaluación también se puede realizar levantando las extremidades inferiores, esperando un aumento de al menos un 15 % en el gasto cardíaco en pacientes que responden al volumen.
Vía de administración: La reposición de volumen debe administrarse preferentemente a través de grandes accesos venosos periféricos (normalmente dos). Sin embargo, si es imposible garantizar el acceso periférico, se debe disponer de un acceso venoso central.
Límite de reposición de volumen: La cantidad de volumen que se administrará al paciente para la reposición de volumen varía con el:
- Tamaño del paciente.
- Estado cardiovascular.
- Tipo de fluido.
- Tipo de shock.
En general, se recomienda una reposición de 20-30 ml/kg en pacientes en shock.
La reposición de volumen debe ser monitoreada en función de los parámetros de perfusión tisular, para determinar mejor el límite de esta reposición. La mejora hemodinámica también es un buen parámetro.
Recuerde: La reposición excesiva de volumen puede provocar varias complicaciones:
- Alteracion en el perfil de coagulación.
- Dilución de eritrocitos, reduciendo la disponibilidad de oxígeno.
- Edema tisular.
- Edema pulmonar.
- Síndrome compartimental abdominal.
Corregir la causa del shock: Si el paciente tiene una causa conocida del shock, debe identificarse y corregirse de inmediato.
Para pacientes con shock hipovolémico debido a hemorragia, inicialmente se debe realizar una infusión de cristaloides hasta que los hemoderivados estén listos para ser administrados.
En relación con los shocks hipovolémicos no hemorrágicos, se deben preferir las soluciones cristaloides a las coloides, ya que estas últimas no han demostrado superioridad sobre las primeras.
Tipos de fluidos
Cristaloides: Son los fluidos más utilizados en la reanimación volumétrica, siendo sus principales representantes:
- Solución salina al 0.9% (SF al 0.9%).
- Ringer lactato.
- Plasma Lyte (suero balanceado en electrolitos)
Las principales consecuencias potenciales de la administración de una gran cantidad de NaCl al 0.9% son la hipernatremia y la acidosis metabólica hiperclorémia, debido a la cantidad supra-fisiológica de cloruro de sodio administrado en esta solución.
El lactato de Ringer, por su parte, se considera una solución más fisiológica, presentando la misma tonicidad que el NaCl al 0.9%, pero con pequeñas cantidades de potasio y calcio, además de concentraciones mucho menores de cloruro.
Su principal complicación es la hiponatremia.
Plasma Lyte tiene menos sodio que la solución salina, pero tiene potasio, gluconato y magnesio, y no contiene lactato.
Debes tener mucho cuidado con:
- Hipercalemia.
- Hipermagnesemia.
- Hiponatremia.
Todos los cristaloides pueden causar edema periférico.
Albúmina: Coloide que se puede utilizar en contracciones del 5 o 20% en frascos de 250-500 mL y 50 mL, respectivamente. Puede utilizarse cuando existan reposiciones de gran volumen (> 2 L), con la intención de reducir el uso excesivo de cristaloides. Su uso está limitado por el alto costo y la falta de una mejor supervivencia en comparación con el uso de cristaloides.
Almidones: El hidroxietilalmidón tiene la ventaja teórica de requerir la infusión de cantidades más pequeñas de líquido para el mismo reemplazo de volumen, en comparación con la reposición con cristaloides. Sus principales riesgos se deben a su alto peso molecular, que puede inducir trastornos de la coagulación y disfunción renal, lo que limita su uso a casos seleccionados. La Surviving Sepsis Campaign (SSC) no recomienda el uso rutinario de estas sustancias, dados sus riesgos potenciales y la baja evidencia de beneficios.
Gelatina: Debido a su riesgo potencial (elevada antigenicidad) y bajo beneficio, no demostrado por estudios de supervivencia, se ha desaconsejado cada vez más su uso.
Reposición de volumen agresiva: 20-30 ml/kg de solución cristaloide, monitorizada por la diuresis, la frecuencia cardíaca y el nivel de conciencia. La hipotermia es común y se puede prevenir mediante el uso de cristaloides calentados.
Variación de la presión del pulso ΔPpulso (ΔPP): Diferencia entre la presión máxima y mínima del pulso, durante la inspiración y la espiración con presión positiva, dividida por la media aritmética de estas presiones, lo que significa en qué porcentaje de la presión promedio varía la presión del pulso. Cuanto mayor sea la variación en la presión del pulso, mayor será la respuesta del paciente a la reposición de volumen, especialmente si > 13%.
El uso de este método está contraindicado en algunas situaciones, como pacientes con arritmias, ventilación mecánica con volumen corriente bajo y respiración espontánea.
Los pacientes con arritmias graves, relación P/F < 100 mmHg o PCAP ≥ 18 mmHg tienden a no responder.
La representación matemática de la variación de la presión de pulso: ΔPP% = 100x {(PPmax – PP min) ÷ [(PPmax + PPmin) ÷2]}.
A pesar de la presentación de todos los líquidos posibles en la reanimación con líquidos, dada la falta de beneficio en los estudios clínicos, se recomienda la reposición con cristaloides isotónicos (SF o Ringer lactato).
No se ha demostrado que las soluciones coloides sean superiores y son más caras y menos disponibles. Deben evitarse las soluciones hiperoncóticas como el hidroxietilalmidón .
Reanimación equilibrada e hipotensión permisiva
El concepto de reanimación equilibrada o hipotensión permisiva se ha estudiado cada vez más en el contexto del shock hipovolémico hemorrágico en trauma.
Debemos equilibrar el riesgo de un aumento de la hemorragia proveniente de fuentes de sangrado que aún no se han controlado definitivamente con el beneficio de mantener valores objetivo de presión arterial más alta. Hablamos de hipotensión permisiva en estos escenarios.
La hipotensión permisiva se asocia con un beneficio de supervivencia en comparación con la estrategia convencional en el shock hemorrágico. Reduce la pérdida de sangre y el uso de hemoderivados.
Referencias bibliográficas
Gattas DJ, Dan A, CHEST Management Committee, et al. Fluid resuscitation with 6 % hydroxyethyl starch (130/0.4 and 130/0.42) in acutely ill patients: systematic review of effects on mortality and treatment with renal replacement therapy. Intensive Care Med. 2013; 39(4):558-568.
Zarychanski R, Abou-Setta AM, Turgeon AF, et al. Association of hydroxyethyl starch administration with mortality and acute kidney injury in critically ill patients requiring volume resuscitation: a systematic review and meta-analysis. JAMA. 2013; 309(7):678-688.
Annane D, Siami S, CRISTAL Investigators, et al. Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized trial. JAMA. 2013; 310(17):1809-1817. Erratum in: JAMA. 2013; 311(10):1071.
Kraut JA, Madias NE. Lactic acidosis. N Engl J Med. 2014; 371(24):2309-2319.
Self WH, Semler MW, SALT-ED Investigators, et al. Balanced Crystalloids versus Saline in Noncritically Ill Adults. N Engl J Med. 2018; 378(9):819-828.
Myburgh J. Patient-Centered Outcomes and Resuscitation Fluids. N Engl J Med. 2018; 378(9):862-863.
Antequera Martín AM, Barea Mendoza JA, Muriel A, et al. Buffered solutions versus 0.9% saline for resuscitation in critically ill adults and children. Cochrane Database Syst Rev. 2019; 7(7):CD012247.
Monnet X, Teboul JL. Prediction of fluid responsiveness in spontaneously breathing patients. Ann Transl Med. 2020; 8(12):790.
Tran A, Yates J, Lau A, et al. Permissive hypotension versus conventional resuscitation strategies in adult trauma patients with hemorrhagic shock: A systematic review and meta-analysis of randomized controlled trials. J Trauma Acute Care Surg. 2018; 84(5):802-808.
Schramko A, Suojaranta-Ylinen R, Kuitunen A, et al. Hydroxyethylstarch and gelatin solutions impair blood coagulation after cardiac surgery: a prospective randomized trial. Br J Anaesth. 2010; 104(6):691-697.
Michard F, Chemla D, Teboul JL. Applicability of pulse pressure variation: how many shades of gray? Crit Care. 2015; 19(1):144.
Wiedermann CJ. Hydroxyethyl starch – can the safety problems be ignored? Wien Klin Wochenschr. 2004; 116(17-18):583-594.
Sugerencias y comentarios al correo: contacto@galenbook.com

