Actualizado 14 mayo 2024
Introducción
El síndrome de respuesta inflamatoria sistémica (SIRS) pediátrico consiste en la presencia de dos o más de los siguientes criterios, siendo uno de ellos el recuento de leucocitos o la alteración de la temperatura:
- Leucocitosis o leucopenia que no se deba a quimioterapia o a la presencia de formas jóvenes de neutrófilos en la sangre periférica.
- Fiebre (> 38ºC para < 3 meses y > 38.5ºC para > 3 meses) o hipotermia (< 36ºC).
- Taquicardia (referencias para cada edad):
- 0 a 3 meses: > 205 lpm.
- De 3 meses a 2 años: > 190 lpm.
- De 2 a 10 años: > 140 lpm.
- Más de 10 años: > 100 pm.
- Necesidad de ventilación mecánica por afección aguda no relacionada con la anestesia general o enfermedad de base neuromuscular o taquipnea (según la edad):
- 0 a 1 año: > 60 rpm.
- 1 a 4 años: > 40 rpm.
- 4 a 6 años: > 34 rpm.
- 6 a 13 años: > 30 rpm.
- Mayores de 13 años: > 16 rpm.
Sepsis: SIRS + foco infeccioso sospechado o confirmado.
Sepsis pediátrica grave: Sepsis asociada con: (1) disfunción respiratoria, (2) cardiovascular, o (3) dos manifestaciones de disfunción de otros sistemas (excluyendo el cardiovascular).
Shock séptico pediátrico: Sepsis grave con disfunción cardiovascular (presencia de hipotensión, necesidad de drogas vasoactivas o perfusión tisular comprometida) que persiste a pesar de la administración de 40 ml/kg o más de solución isotónica en una hora. En la práctica, se define como hipoperfusión que no responde a la expansión de volumen.
Shock séptico refractario:
- Refractario a volumen: Persistencia de disfunción cardiovascular a pesar de la administración de 40 a 60 ml/kg de solución isotónica.
- Refractario a catecolaminas: Persistencia de disfunción cardiovascular a pesar de la administración de 10 microgramos/kg/minuto o más de Dopamina y/u otras catecolaminas de acción directa (Adrenalina o Noradrenalina).
En el 2016, se publicaron nuevas definiciones y criterios en adultos, y la definición de «sepsis» se cambió a «disfunción orgánica potencialmente mortal causada por una respuesta desregulada del huésped a la infección», y la de «shock séptico» se convirtió en «un subconjunto de la sepsis». con disfunción circulatoria y celular/metabólica asociada con un mayor riesgo de mortalidad».
El estudio que describió el nuevo escore de sepsis de Phoenix (Schlapbach LJ et al., 2024) sugirió que los criterios de SIRS ya no deberían usarse para diagnosticar la sepsis pediátrica, ya que no identifica adecuadamente a los niños con alto riesgo de resultados negativos. Además, también desaconseja el uso del término sepsis grave, ya que la sepsis en sí misma se define como una disfunción orgánica asociada a una infección, y esto, en sí mismo, caracteriza una enfermedad grave. Por lo tanto, la sepsis y el shock séptico deben definirse y diagnosticarse con base en este escore (ver más abajo en los Criterios de diagnóstico).
Fisiopatología
Cuando se da la invasión por un patógeno, el organismo del huésped organiza una respuesta inflamatoria para combatir al agresor, con la secreción de varias citoquinas pro y antiinflamatorias, además de componentes de la inmunidad celular y humoral.
El equilibrio alterado entre la respuesta inflamatoria y antiinflamatoria reguladora es el principal determinante de la aparición de sepsis. Los pacientes con sepsis presentan desregulación inmune con una respuesta inflamatoria exacerbada, con el consiguiente daño endotelial y otros procesos fisiopatológicos que culminan en las posibles lesiones asociadas a la afección.
Presentación clínica
Pregunta sobre antecedentes mórbidos: Prematuridad, enfermedades perinatales, destete precoz, enfermedades y hospitalizaciones previas, enfermedades crónicas, uso de medicamentos, cirugías o procedimientos médicos, enfermedades y hábitos familiares, antecedentes personales o familiares de inmunodeficiencia, tratamiento oncológico, asplenia.
La evaluación del foco infeccioso primario se orientará según las quejas del paciente o de su tutor.
Examen físico
- Primeros meses de vida: Los cambios son inespecíficos, incluyendo: Letargia, piel pálida o marmoleada, vómitos y problemas de alimentación. Tardíamente los signos y síntomas pueden parecerse a los de niños mayores (bradicardia, mala perfusión periférica, apnea, gemidos, cianosis, irritabilidad, convulsiones, fontanela abombada, distensión abdominal, ictericia, hepatoesplenomegalia, rash cutáneo , entre otros).
- Lactantes y niños mayores: Puede presentarse con fiebre, escalofríos, postración, irritabilidad, palidez, rash cutáneo, ictericia, distensión abdominal e íleo paralítico. En casos más avanzados, las manifestaciones pueden indicar ya complicaciones derivadas de disfunciones orgánicas (sangrado, insuficiencia renal/hepática).
Enfoque diagnóstico
Los criterios clínicos sumados a los resultados de laboratorio ayudan en el diagnóstico y guían el tratamiento.
Se deben utilizar exámenes de laboratorio para identificar y controlar la sepsis en niños, aunque ninguna de ellos es muy sensible y específica en esta población.
Exámenes de laboratorio: Hemograma completo, cultivos de focos sospechosos, hemocultivo, urocultivo, uroanálisis, glucosa en sangre, electrolitos, incluido el calcio sérico, función renal (urea, creatinina), hepatograma (TGO, TGP, bilirrubina), gases arteriales, lactato, PCR, VHS, pruebas de coagulación (tiempo de protrombina, tiempo de tromboplastina parcial activa, índice estandarizado internacional, fibrinógeno, dímero D), pruebas para la identificación viral.
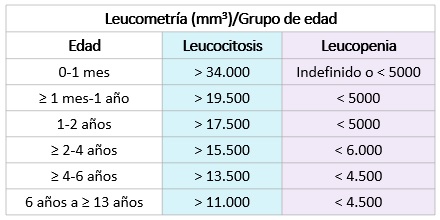
Hemograma completo con diferencial: Se deben tener en cuenta los valores específicos para cada grupo de edad:
Lactato: Marcador de hipoperfusión tisular. Valores normales: < 4 mg/dL o < 1 mmol/L. Los niños con niveles elevados de lactato deben ser examinados precozmente para detectar sepsis ya que puede progresar a sepsis grave y shock. La evaluación seriada del lactato sérico está indicada para guiar la reanimación de niños con shock séptico o disfunción orgánica relacionada con sepsis.
Biomarcadores: VHS, Proteína C-reactiva, procalcitonina, ferritina, Están directamente relacionados con la respuesta inflamatoria y son potencialmente útiles para monitorear la respuesta al tratamiento mediante mediciones seriadas.
Cultivos: Son los mejores marcadores de infección. Realizar cultivos de sangre, orina, LCR, heces, secreciones, exudados, petequias e infusiones, según el foco sospechoso. Preferiblemente, recolectar cultivos antes de la infusión de antibióticos. Recoger al menos dos hemocultivos de los cuales al menos uno debe ser percutáneo, y recolectar cultivos de cada acceso vascular utilizado durante más de 48 horas.
En caso de sospecha de infección por hongos: Solicitar pruebas de hifas en orina y hemocultivos para hongos en pacientes con factores de riesgo de infección por hongos: Uso de múltiples esquemas antibióticos y/o antibióticos de amplio espectro, nutrición parenteral, uso prolongado de catéter central, colonización del tracto digestivo por Candida, presencia de malignidad u otras condiciones que causan inmunosupresión y neutropenia prolongada (> 4 a 7 días).
Estudios de imagen: Radiografía de tórax, ultrasonido, tomografía (según la localización del foco sospechoso).
Criterios de diagnóstico
El escore de sepsis de Phoenix (2024)
Es un escore para evaluar la disfunción orgánica ante una condición infecciosa, es decir, para diagnosticar la sepsis (en su definición más actual). No es una herramienta para el diagnóstico precoz ni el manejo preventivo de la disfunción orgánica.
Debe utilizarse en pacientes con edad post-natal ≥ 37 semanas, hasta pacientes de 18 años.
Según la puntuación de las siguientes tablas, tendremos:
- Sepsis: Sospecha de infección y escore de sepsis de Phoenix ≥ 2 puntos.
- Shock séptico: Sepsis con ≥ 1 punto en la evaluacion del sistema cardiovascular.
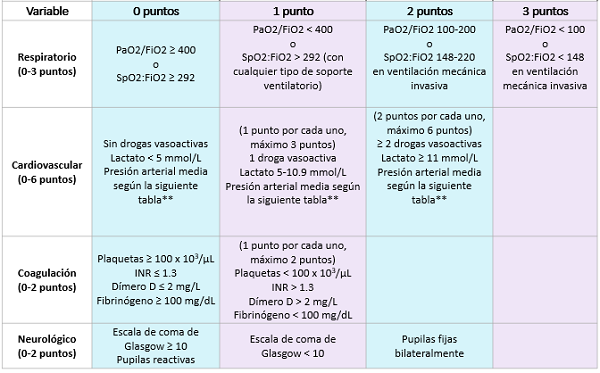
Sepsis severa
- Sepsis asociada a: Disfunción orgánica cardiovascular o síndrome de dificultad respiratoria aguda (SDRA) o dos o más disfunciones orgánicas de otros sistemas.
- Observación: Aunque la puntuación de Phoenix desaconseja esta nomenclatura, decidimos mantenerla en el texto, ya que todavía se usa ampliamente en el contexto clínico.
Criterios para disfunción de órganos
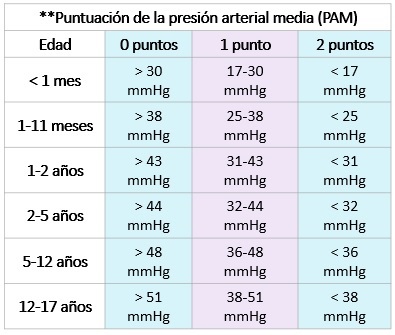
- Disfunción cardiovascular: A pesar de la administración de un bolo ≥ 40 ml/kg en 1 hora de solución isotónica endovenosa, el paciente desarrolla: (1) disminución de la presión arterial < percentil 5 para la edad o PAS < 2 desviaciones estándar por debajo de lo normal para la edad, ( 2) necesidad de un fármaco vasoactivo para mantener la presión arterial normal o (3) dos de los siguientes:
- (a) Acidosis metabólica inexplicable (déficit de base > 5 mEq/L).
- (b) El lactato arterial aumentado más de 2 veces el límite superior normal.
- (c) Oliguria (DU < 1 ml/kg/hora).
- (d) Tiempo de llenado capilar prolongado (> 2 segundos).
- (e) Diferencia en la temperatura corporal central y periférica > 3°C.
- Disfunción respiratoria:
- PaO2 /FiO2 < 300 en ausencia de enfermedad cardíaca cianótica o neumopatía preexistente.
- PaCO2 > 20 mmHg de la PaCO2 de base.
- Necesidad comprobada de 50% de FiO2 para mantener la saturación ≥ 92%, o necesidad de ventilación mecánica invasiva o no invasiva.
- Disfunción neurológica:
- Glasgow ≤ 11 o variación aguda en el estado mental con una disminución de Glasgow ≥ 3 puntos desde el valor de base anormal.
- Disfunción hematológica:
- Recuento de plaquetas < 80.000/mm3.
- Disminución del 50 % en el recuento de plaquetas del valor más alto registrado en los últimos 3 días (pacientes oncológicos/hematológicos crónicos).
- INR ≥ 2.
- Disfunción renal:
- Creatinina sérica ≥ 2 veces el límite superior para la edad.
- Aumento de 2 veces el valor de creatinina sérica basal.
- Disfunción hepática:
- Bilirrubina total ≥ 4 mg/dL (no aplicable para neonatos).
- TGP 2 veces > límite superior para la edad.
Diagnóstico diferencial
- Otras causas del SIRS.
- Hipoglicemia.
- Quemaduras.
- Trauma.
- Pancreatitis.
- Enfermedades cardiovasculares.
- Hipertermia ambiental.
- Crisis convulsivas.
- Errores innatos del metabolismo.
- Hiperplasia suprarrenal congénita.
- Intoxicaciones.
- Encefalopatía bilirrubinica.
- Enterocolitis necrotizante.
- Enfermedades autoinmunes.
- Rechazo a trasplantes, entre otros.
Seguimiento
Hospitalización: Todos los pacientes con sepsis sospechada/confirmada deben ser admitidos para recibir antibióticos parenterales y monitorización.
Ingreso en UCI: Criterios de sepsis grave, shock séptico o disfunción orgánica.
Enfoque terapéutico
En los primeros 5 minutos, se debe identificar si hay reducción de la perfusión y del nivel de conciencia, suministrar oxígeno mediante mascarilla con reservorio no reinhalable con 10 L de O2 /minuto en < 1 año y 15 L/minuto en > 1 año. Evaluar la necesidad de ventilación mecánica invasiva o no invasiva. Obtener acceso endovenoso o acceso intraóseo si el acceso periférico es imposible.
Reanimación volémica en niños con disfunción orgánica relacionada a sepsis y/o shock séptico: Se debe preferir el uso de cristaloides balanceados/tamponados (como Ringer lactato o Plasma-Lyte) para la reanimación volémica en niños, en lugar de albúmina o SF al 0.9%.
- Centros con disponibilidad de UCI pediátrica: Administrar 40-60 ml/kg de volumen en la primera hora (10-20 ml/kg en cada bolo), titulando según los marcadores de sobrecarga de volumen, como estertores pulmonares o hepatomegalia, incluidos los marcadores de gasto cardíaco, lactato sérico y monitorización avanzada, cuando sea posible.
- Centros sin disponibilidad de UCI pediátrica y niños sin hipotensión: En este caso no se recomienda realizar expansión de volumen en bolo, debiéndose iniciar hidratación endovenosa de mantenimiento habitual dentro de la primera hora.
- Centros sin disponibilidad de UCI pediátrica y niños con hipotensión: Administrar 40 mL/kg de volumen en la primera hora (10-20 mL/kg en cada bolo), titulando por marcadores de sobrecarga de volumen, como estertores pulmonares o hepatomegalia.
Soporte inotrópico de primera línea: Después de realizar reanimación con volumen, si no hay respuesta clínica (taquicardia mantenida, mala perfusión periférica y/o hipotensión), o, incluso, si hay sobrecarga de volumen antes de finalizar la etapa de reanimación con volumen = shock refractario al volumen = utilizar soporte farmacológico de primera línea, según clasificación del shock:
- Shock con bajo gasto cardíaco: El principal fármaco es la adrenalina (0.05-0.3 microgramos/kg/minuto) por vía endovenosa en infusión continua.
- Shock hipotensivo: El principal fármaco es noradrenalina (0.1-1 microgramos/kg/minuto) en infusión continua.
Es importante resaltar que las aminas (drogas vasoactivas) pueden iniciarse por acceso venoso periférico o intraóseo, no debiendo retrasarse el inicio de estos medicamentos. Sin embargo de igual forma lo antes posible se debe obtener un acceso venoso central para continuar con la aplicación medicamentos.
No hay evidencia que priorice la noradrenalina o la adrenalina como agentes vasoactivos iniciales para niños con shock refractario al volumen.
En estos casos se pueden utilizar ambos medicamentos, ya que ambos tienen efectos vasopresores e inotrópicos, ajustándose posteriormente según la fisiología del shock del paciente (evaluada mediante medidas de monitorización más avanzadas).
Una pauta reciente es no utilizar únicamente los signos clínicos al lado de la cama para establecer el tipo de shock. Cuando estén disponibles, utilice parámetros avanzados, como la evaluación del índice cardíaco, la resistencia vascular periférica y la saturación venosa central oxigeno (ScvO2).
El tratamiento de shock mediante la evaluación de si el shock es «frío» o «caliente» ya no está indicado. Esto se debe a que se observó que la evaluación clínica de este tipo de shock no siempre corresponde a la fisiología del shock del paciente.
Uso de vasopresina: No existe consenso sobre el momento oportuno para el uso de vasopresina en pacientes con shock que requieren altas dosis de catecolaminas. Por lo tanto, la decisión debe estar de acuerdo con la preferencia del médico tratante.
Uso de inodilatadores: Para el uso de inodilatadores, como Milrinona, Dobutamina o Levosimendán, no fue posible establecer, en el último consenso de 2020, recomendaciones al respecto. Pese a ello, suelen iniciarse en casos de shock séptico con evidencia de hipoperfusión y disfunción cardíaca, a pesar del uso de otros agentes vasoactivos.
Objetivos terapéuticas para el tratamiento del shock séptico:
- Perfusión capilar periférica ≤ 2 segundos.
- No se ha establecido el valor objetivo de presión arterial media (PAM), apuntando a una PAM entre los percentiles 5-50 y/o > 50 para la edad. Es razonable trabajar con valores de presión arterial sistólica cuando la PAM no se puede evaluar adecuadamente.
- Pulsos normales sin diferencia entre pulsos centrales y periféricos.
- Extremidades calientes.
- Diuresis > 1 ml/kg/hora.
- Estado mental normal.
- Saturación venosa central > 70%.
- Índice cardíaco de 3.3-6 L/minuto/m2.
Corticoides: Es posible tratar con Hidrocortisona (dosis de ataque de 100 mg/m2/día, seguido de la misma dosis dividida en cada 6 horas), durante 5-7 días, hasta suspender las aminas vasoactivas en niños con shock refractario a líquidos y resistente a catecolaminas (con dosis de Noradrenalina o Adrenalina > 0.6 microgramos/kg/minuto EV), aunque no existe consenso a favor o en contra de su uso.
Sin embargo, en pacientes con exposición aguda o crónica a corticoides, trastornos del eje hipotalámico-pituitario-suprarrenal, hiperplasia suprarrenal congénita u otras endocrinopatías relacionadas con los corticoides, o que hayan sido tratados recientemente con ketoconazol o etomidato, el uso de corticoides es obligatorio.
Monitorización mínima: Oximetría de pulso, trazado de ECG, medición de la presión arterial por cualquier método, temperatura, diuresis horaria, glucosa y calcio sérico.
Antibióticos y control de la fuente: Iniciar antibióticos empíricos y apropiados hasta 1 hora después de identificar el shock séptico, o hasta 3 horas después identificar la disfunción orgánica asociada a la sepsis sin shock (iniciar el antibiótico lo antes posible).
Los esquemas antibióticos empíricos dependen del grupo de edad y del foco infeccioso. Ajustar la terapia con antibióticos según los resultados de los cultivos. Tiempo de tratamiento: 7-10 días (evaluar según el microorganismo, tipo de infección y estado inmunológico del paciente).
Se debe controlar las fuente infecciosa lo antes posible, incluyendo el retiro de los catéteres venosos cuando estos sean la fuente de infección.
Esquemas antibióticos posibles
- Niños previamente sanos con sepsis adquirida en la comunidad: Las cefalosporinas de tercera generación (ej. ceftriaxona) suelen ser suficientes:
- Alta prevalencia de estafilococos meticilino resistentes (SAMR) o neumococos resistentes a ceftriaxona: Agregue vancomicina.
- Alta prevalencia de bacterias gramnegativas resistentes a ceftriaxona: Agregar aminoglucósido o reemplazar por carbapenémicos.
- 1 -3 meses: Foco respiratorio o indeterminado: Oxacilina (+/- Ceftriaxona).
- Presencia de neumonía intersticial: Agregar claritromicina.
- Foco digestivo o urinario: Ceftriaxona + Gentamicina.
- Foco del sistema nervioso central: Vancomicina + Ceftriaxona.
- Después de 3 meses: Ceftriaxona (+/- Oxacilina)
- Si hay sospecha de SAMR: Agregar vancomicina y/o clindamicina hasta que los resultados del cultivo estén disponibles.
- Recién nacido (0 a 28 días): Penicilina G cristalina o Ampicilina (la ampicilina tiene acción contra Listeria) asociada a Gentamicina o Amikacina.
- Pacientes inmunocomprometidos o con sepsis adquirida en ambiente hospitalario: Cefalosporina antipseudomonas de tercera generación o superior (Cefepime), carbapenémico de amplio espectro (Imipenem) o la combinación de Penicilina + inhibidor de beta-lactamasas de rango extendido (Piperacilina tazobactam).
- Pacientes con infección intraabdominal sospechada o confirmada: Cobertura para patógenos intraabdominales, incluidas bacterias anaeróbicas, con un carbapenémico, penicilina + inhibidor de beta-lactamasa de rango extendido (Piperacilina tazobactam) o adicionar Clindamicina o Metronidazol.
- Sospecha de síndrome de shock tóxico o fascitis necrotizante: Incluya Clindamicina o Lincomicina.
- Región endémica de parasitosis (ej. malaria) o rickettsiosis: Considerar el tratamiento empírico según la epidemiología local y sospechada.
- A cualquier edad, si hay coma o signos de encefalitis: Agregar Aciclovir.
Sepsis refractaria: Si > 7-10 días de tratamiento sin mejoría y no se identifica el agente causal, se debe sospechar inmunodeficiencia, infección por Candida o anaerobios.
Hemotransfusión: La indicación de transfusión de concentrados de glóbulos rojos en pacientes con shock séptico es para hemoglobina < 7 g/dL, si existe estabilidad hemodinámica. No hay evidencia sobre el umbral para la transfusión de glóbulos rojos en pacientes inestables.
No existen indicaciones específicas para la transfusión profiláctica de plaquetas sin sangrado activo. A pesar de esto, la transfusión suele realizarse cuando las plaquetas < 20.000/mm3 asociada a la necesidad de realizar procedimientos. En caso de hemorragia activa con trombocitopenia, está indicada la transfusión de plaquetas.
Está indicado el tratamiento con plasma para corregir los trastornos de la púrpura trombótica inducida por la sepsis en niños, incluida la coagulación intravascular diseminada (CID), la microangiopatía trombótica secundaria y la púrpura trombocitopénica trombótica. No está indicada la transfusión profiláctica de plasma humano.
Control glicémico: Control glicémico con objetivo de mantenimiento ≤ 180 mg/dL. Dar preferencia a un esquema de insulina en lugar de infusión continua, debido al menor riesgo de hipoglicemia.
Diuréticos y terapia de reemplazo renal: Los diuréticos (Furosemida 0.5 mg/kg/dosis) se utilizan para revertir la sobrecarga de volumen inicial después de la resolución del shock y, en caso de refractariedad, puede estar indicada la terapia de reemplazo renal (hemodiálisis o diálisis peritoneal) para prevenir la pérdida la sobrecarga de liquido >10% del peso corporal.
No hay prevención específica para la trombosis venosa profunda o las úlceras gástricas por en niños.
La nutrición enteral debe iniciarse en niños que puedan ser alimentados por vía enteral, preferentemente dentro de las 48 horas y a través de sonda gástrica (las sondas post-pilóricas sólo deben utilizarse si existen indicaciones específicas para su uso), pudiendo iniciarse de forma trófica y progresiva hasta alcanzar las necesidades nutricionales.
No se debe suspender la nutrición enteral basándose únicamente en la administración de drogas vasoactivas, siempre y cuando el paciente tenga una adecuada reanimación hemodinámica y no requiera aumento de las drogas vasoactivas, ni se esté destetando las mismas.
En los casos en que sea necesario el uso de nutrición parenteral, se debe postergar la misma durante los primeros 7 días de ingreso a la UCI.
Si es necesario realizar intubación orotraqueal, se debe evitar el uso de Etomidato para intubar a niños con shock séptico (riesgo de insuficiencia suprarrenal y aumento de mortalidad).
También se debe prestar atención al uso de sedantes que empeoran la hipotensión y a la influencia de la presión positiva en el empeoramiento de la función cardíaca tras el inicio de la ventilación mecánica. Aunque no existe una indicación específica para un esquema de medicamentos sedantes, la combinación de Ketamina y Fentanilo parece ser segura.
Prescripción hospitalaria
Pautas para el prescriptor
- Antibioticoterapia:
- Depende del tipo de microorganismo sospechado o confirmado, del sitio de infección y de la situación inmunológica del paciente.
- El tiempo de tratamiento suele variar entre 7 y 10 días.
- Si es necesario, use aciclovir. La duración del tratamiento es de 21 días.
- Dieta e hidratación – Elige una de las siguientes opciones:
- Dieta cero: Pacientes hemodinámicamente inestables, que requieren un aumento progresivo de las drogas vasoactivas.
- Dieta enteral: Pacientes con adecuada reanimación con líquidos, sin necesidad de aumento de drogas vasoactivas ni se encuentren en destete de las mismas
- Hidratación endovenosa de mantenimiento: Preparar una solución para administrar por via endovenosa en 24 horas con los siguientes elementos (ajuste según los electrolitos séricos y el balance hídrico del paciente):
- Suero glucosado al 5% Indicar los siguientes volúmenes por via endovenosa en 24 horas (se pueden dividir en cuatro etapas):
- 0-10 kg: 100 ml/kg/día.
- 10-20 kg: 1.000 mL + 50 mL/kg por cada kg de peso por encima de los 10 kg.
- > 20 kg: 1.500 mL + 20 mL/kg por cada kg de peso por encima de los 20 kg.
- NaCl 20%: Volumen de NaCl al 20 % = (volumen de la etapa) x (osmolaridad deseada)/6800. La osmolaridad inicial sugerida es de 300. Ajustar según el sodio sérico.
- KCl 10%: 1.5 ml/kg/día (2 mEq/kg/día) EV (se puede dividir en cuatro etapas). Iniciar sólo en pacientes con diuresis y ajustar según el potasio sérico.
- Suero glucosado al 5% Indicar los siguientes volúmenes por via endovenosa en 24 horas (se pueden dividir en cuatro etapas):
- Resucitación volémica – Elige una de las siguientes opciones:
- Centros con disponibilidad de UCI pediátrica: Ringer lactato 40-60 ml/kg EV en la primera hora (10-20 ml/kg en cada bolo), titulando según marcadores de sobrecarga de volumen.
- Centros sin disponibilidad de UCI pediátrica y niños con hipotensión: Ringer lactato 40 ml/kg EV en la primera hora (10-20 ml/kg en cada bolo), titulando según marcadores de sobrecarga de volumen.
- Centros sin disponibilidad de UCI pediátrica y niños sin hipotensión: No administrar líquidos en bolo. Iniciar líquidos de mantenimiento (descritos anteriormente).
Antibioticoterapia
Separar las dosis al final. Elija uno de los esquemas según la presentación clínica:
- Esquema A: Recién nacidos sin alteraciones del SNC: Asociación:
- Ampicilina + Gentamicina.
- Esquema B: Recién nacidos sin alteraciones del SNC: Asociación:
- Ampicilina + Gentamicina + Cefotaxima.
- Esquema C: Recién nacidos con alteraciones del SNC, coma o signos de encefalitis: Asociación:
- Ampicilina + Gentamicina + Cefotaxima + Aciclovir.
- Esquema D: Niños de 1 a 3 meses con foco respiratorio o indeterminado: Asociación:
- Oxacilina + Ceftriaxona.
- Esquema E: Niños de 1 a 3 meses con sospecha de neumonía intersticial: Asociación:
- Oxacilina + Ceftriaxona + Claritromicina
- Esquema F: Niños de 1 a 3 meses con foco abdominal o urinario: Asociación:
- Ceftriaxona + Gentamicina.
- Esquema G: Niños de 1 a 3 meses con alteraciones del SNC, coma o signos de encefalitis: Asociación:
- Vancomicina + Ceftriaxona + Aciclovir.
- Esquema H: Niños > 3 meses sin sospecha de SAMR: Asociación:
- Oxacilina + Ceftriaxona.
- Esquema I: Niños > 3 meses con sospecha o confirmación de SAMR: Asociación:
- Vancomicina + Ceftriaxona.
- Esquema J: Niños > 3 meses con alteraciones en el SNC, coma o signos de encefalitis: Asociación:
- Vancomicina + Ceftriaxona + Aciclovir.
Tratamiento farmacológico – Dosis de antibióticos
- Ampicilina:
- Neonatos sin enfermedad del SNC:
- ≤ 34 semanas de edad gestacional:
- ≤ 7 días de vida: 50 mg/kg/dosis EV cada 12 horas.
- 8-28 días de vida: 75 mg/kg/dosis EV cada 12 horas.
- > 34 semanas de edad gestacional: 50 mg/kg/dosis EV cada 8 horas.
- ≤ 34 semanas de edad gestacional:
- Neonatos con enfermedad del SNC:
- ≤ 7 días de vida: 200-300 mg/kg/dosis EV cada 8 horas.
- > 7 días de vida: 300 mg/kg/día EV cada 6 horas.
- Neonatos sin enfermedad del SNC:
- Gentamicina:
- Neonatos < 30 semanas de edad gestacional:
- ≤ 14 días de vida: 5 mg/kg/dosis EV cada 48 horas.
- > 14 días de vida: 5 mg/kg/dosis EV cada 36 horas.
- Neonatos con edad gestacional entre 30-34 semanas:
- ≤ 14 días de vida: 5 mg/kg/dosis EV cada 36 horas.
- > 14 días de vida: 5 mg/kg/dosis EV cada 24-36 horas.
- Neonatos ≥ 35 semanas de edad gestacional:
- ≤ 7 días de vida: 4 mg/kg/dosis EV cada 24 horas.
- > 7 días de vida: 5 mg/kg/dosis EV cada 24 horas.
- > 28 días de vida: 2-2.5 mg/kg/dosis EV cada 8 horas o 4.5-75 mg/kg/día EV cada 24 horas.
- Neonatos < 30 semanas de edad gestacional:
- Cefotaxima:
- Neonatos < 1 semana de edad: 50-100 mg/kg/día EV dividido en cada 12 horas.
- Neonatos de 1 a 4 semanas de edad: 75 a 150 mg/kg/día EV dividido en cada 8 horas.
- Oxacilina:150-200 mg/kg/día EV dividido en cada 4-6 horas:
- Dosis máxima: 12 g/día.
- Ceftriaxona: 100 mg/kg/día EV dividido en cada 12 o en dosis única cada 24 horas.
- Dosis máxima: 4.000 mg/día.
- Claritromicina: 7.5 mg/kg/dosis EV cada 12 horas.
- Dosis máxima: 1.000 mg/dosis.
- Vancomicina: 15 mg/kg/dosis EV cada 6 horas.
- Dosis máxima: 3.600 mg/día.
- Aciclovir:
- Neonatos: 20 mg/kg/dosis EV cada 8 horas durante 21 días.
- > 28 días de vida: 10-15 mg/kg/dosis EV cada 8 horas durante 21 días.
Tratamiento farmacológico – Dosis de drogas vasoactivas
- Drogas vasoactivas: Elija una de las siguientes opciones o asocielas según necesidad clínica:
- Adrenalina (1 mg/mL):
- Dilución estándar: 1 mL de Adrenalina + 99 mL de SG al 5% (concentración de 10 microgramos/mL).
- Dosis en dilución estándar: 0.3-1.8 ml/kg/hora (0.05-0.3 microgramos/kg/minuto) EV en infusión continua. Dosis máxima: 6 ml/kg/hora (1 microgramo/kg/minuto).
- Noradrenalina (2 mg/mL):
- Dilución estándar: 2 mL de Noradrenalina + 248 mL de SG al 5% (concentración de 8 microgramos/mL).
- Dosis en dilución estándar: 0.375-0.75 ml/kg/hora (0.05-0.1 microgramos/kg/minuto) EV en infusión continua. Dosis habitual: 15 ml/kg/hora (2 microgramos/kg/minuto) EV en infusión continua.
- Adrenalina (1 mg/mL):
Tratamiento farmacológico – Dosis de corticoides
- Hidrocortisona: 100 mg/m2/día EV dividido en cada 6 horas.
Cuidados
- Evaluar signos vitales cada 3 horas.
- Observar balance hídrico cada 3 horas.
- Monitorización electrocardiográfica y oximetría de pulso.
- Presión arterial no invasiva o invasiva.
- Oxigenoterapia, ventilación mecánica no invasiva o invasiva.
- Cabecera elevada a 30°.
- HGT cada 6 horas.
Referencias bibliográficas
Kliegman RM, Geme JS, Blum N. Nelson Textbook of Pediatrics. 21st ed. Philadelphia: Elsevier, 2020.
Pomerantz WJ, Weiss SL. Systemic inflammatory response syndrome (SIRS) and sepsis in children: Definitions, epidemiology, clinical manifestations, and diagnosis [Internet]. UpToDate. Waltham, MA: UpToDate Inc. (Accessed on Nov 26, 2022).
Pomerantz WJ, Weiss SL. Septic shock in children: Rapid recognition and initial resuscitation (first hour) [Internet]. UpToDate. Waltham, MA: UpToDate Inc. (Accessed on Nov 26, 2022).
Schlapbach LJ, Watson RS, Sorce LR, et al. International Consensus Criteria for Pediatric Sepsis and Septic Shock. JAMA. 2024;331(8):665-74.
Weiss SL, Peters MJ, Alhazzani W, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Intensive Care Med. 2020; 46(Suppl 1):10-67.
Davis AL, Carcillo JA, Aneja RK, et al. American College of Critical Care Medicine clinical practice parameters for hemodynamic support of pediatric and neonatal septic shock. Crit Care Med. 2017; 45(6):1061-93.
Gonin MLC. Current developments in pediatric sepsis and septic shock. SOPERJ Pediatrics Magazine. 2012; 13(2):77-89.
Kawasaki T. Update on pediatric sepsis: a review. J Intensive Care. 2017; 5:47.
Sugerencias y comentarios al correo: contacto@galenbook.com

