Actualizado 12 junio 2024
Definición
Sangrado digestivo con origen por encima del ángulo de Treitz, cuyas principales causas son la enfermedad ulcerosa péptica, las várices esofágicas y el síndrome de Mallory-Weiss.
Etiología
- Úlcera péptica (31-67%).
- Gastritis/duodenitis (7-31%).
- Sangrado varicoso (4-20%).
- Esofagitis erosiva (3-12%).
- Mallory-Weiss (4-8%).
- Tumores (2-8%).
- Fístulas aortoentéricas, malformaciones arteriovenosas y Dieulafoy (2-8%).
Presentación clínica
- Epidemiología: 100 casos por cada 100.000 personas/año. Específicamente, entre los pacientes cirróticos, el 50% tiene várices esofágicas y alrededor de un tercio de ellos experimentará hemorragia gastrointestinal superior.
- Cuadro clásico: Hematemesis y/o melena, acompañada de dolor abdominal. La presencia de sangrado franco exteriorizado en forma de hematemesis o hematoquecia, asociado con hipotensión arterial, sugiere una afección grave, mientras que la presencia de sangrado en «borra de café» sugiere un sangrado más limitado.
- Melena: Heces ennegrecidas, «en borra de café». El 90% de los episodios de melena se originan por sangrado por encima del ángulo de Treitz (alto); sin embargo, ocasionalmente puede originarse en el intestino delgado y el colon derecho.
- Síntomas que sugieren una etiología específica:
- Enfermedad ulcerosa péptica: Dolor epigástrico o dolor en el cuadrante superior derecho.
- Várices esofágicas: Signos de hipertensión portal o insuficiencia hepática crónica: Distensión abdominal (ascitis), ictericia, presencia de circulación colateral, debilidad, eritema palmar y otros estigmas de hepatopatía crónica (ginecomastia, araña vascular, circulación colateral en «cabeza de medusa»);
- Síndrome de Mallory-Weiss: Náuseas y vómitos exacerbados o tos que preceden a la hematemesis. Historia de la libación alcohólica. Ocurre debido a la laceración de la mucosa de la unión esófago-gástrica.
- Malignidad: Pérdida de peso, caquexia, disfagia y saciedad precoz.
- Úlcera esofágica: Disfagia, odinofagia, pirosis, dolor retroesternal.
- Antecedentes patológicos: Cuestionar episodios previos de sangrado digestivo (60% de los sangrados recurrentes se originan en la misma lesión); evaluar la presencia de factores de riesgo/etiológicos:
- Diagnóstico previo de cirrosis, síndrome de hipertensión portal, esquistosomiasis hepatoesplénica, gastropatía por hipertensión portal y várices esófago-gástricas.
- Alcoholismo.
- Uso de medicamentos potencialmente ulcerógenos.
- Antecedentes de gastritis, infección por H. pylori, tabaquismo y úlcera péptica.
- Antecedentes de malignidad.
- Angiodisplasia.
- Fístula aorto-entérica en un paciente con antecedentes de aneurisma de aorta abdominal.
- Anastomosis gastroentérica con riesgo de úlceras marginales.
- Comorbilidades: Evaluar condiciones que puedan contribuir al sangrado y/o evolución desfavorable:
- Coagulopatías, trombocitopenia, disfunción hepática.
- Predisposición a la sobrecarga de volumen: Insuficiencia cardíaca y enfermedad renal crónica.
- Predisposición a la hipoxemia: Enfermedad coronaria y enfermedad pulmonar crónica.
- Antecedentes medicamentosos: Evaluar el uso de bifosfonatos, antiinflamatorios no esteroides, antiagregantes plaquetarios (ej. ácido acetilsalicílico, ticagrelor, clopidogrel) y anticoagulantes (ej. warfarina, rivaroxabán, dabigatrán, etc).
Examen físico
El objetivo principal es evaluar la estabilidad hemodinámica del paciente y estimar la pérdida de volumen:
- Paciente sin hipotensión ni taquicardia (pérdida de volumen < 15%).
- Paciente con hipotensión postural o taquicardia en reposo (pérdida de volumen entre 15-30%).
- Shock hipovolémico: Hipotensión (PAS < 90 mmHg) + disminución del nivel de conciencia + extremidades frías (pérdida de volumen estimada > 40%).
Presencia de dolor abdominal: El dolor abdominal intenso con signos de defensa debe hacer sospechar una perforación, la cual debe descartarse antes de realizar una endoscopia digestiva alta, mediante examen radiológico de rutina de abdomen agudo o tomografía de abdomen y pelvis.
El examen físico también debe complementar la historia clínica para determinar el diagnóstico. La presencia de estigmas de cirrosis hepática sugiere hemorragia por várices esofagogástricas como causa de HDA.
Si se sospecha hemorragia gastrointestinal baja, se debe incluir tacto rectal y anoscopia.
Enfoque diagnóstico
Antes de cualquier abordaje diagnóstico, la estabilización clínica del paciente es fundamental. Se deben obtener dos accesos venosos grandes y se debe iniciar rápidamente la reposición de volumen. Se debe monitorizar al paciente y suspender la dieta. En presencia de inestabilidad hemodinámica, también se recomienda colocar una sonda vesical permanente, controlar la diuresis y los signos vitales, y derivar al paciente a cuidados intensivos.
Luego de la estabilización inicial, se solicitan pruebas de laboratorio y se evalúa la indicación de exámenes de imagen y endoscópicos al abordar al paciente.
Exámenes de laboratorio de rutina:
- Hemograma completo
- Electrolitos
- Urea y creatinina
- Glicemia
- Transaminasas (TGO y TGP)
- Fosfatasa alcalina (FA) y gammaglutamiltransferasa (GGT)
- Bilirrubinas
- Albúmina y proteína total
- Tiempo de Protrombina (TP) y Tiempo de Tromboplastina Parcial activado (TTPa)
- Proteína C Reactiva (PCR)
- Lactato
- Gasometría arterial
Objetivos principales: Evaluar el grado de anemia e indicación de transfusión sanguínea; evaluar coagulopatías y trombocitopenia, considerando también transfusión; evaluar la enfermedad hepática crónica; evaluar criterios de gravedad como empeoramiento de la función renal, aumento del lactato y acidosis metabólica.
Lavado nasogástrico: Poco utilizado en la actualidad. El lavado nasogástrico puede ser útil para identificar el sitio del sangrado (si el sitio no está claro) o limpiar el estómago antes de la endoscopia superior:
- Si el suero regresa con sangre: Sangrado gastrointestinal superior.
- Si el suero regresa con bilis (píloro abierto) y sin sangre: Sangrado digestivo bajo.
- Si el suero regresa sin bilis (píloro cerrado) y sin sangre: No se puede descartar una hemorragia digestiva alta.
Endoscopia digestiva alta: Indicada en todos los pacientes con hemorragia digestiva alta, y debe realizarse tan pronto como el paciente esté estabilizado (en pacientes inestables al ingreso) o dentro de las 12 (sangrado por várices) a 24 horas (sangrado ulcerativo) en pacientes estables, sin signos de gravedad. Tiene importancia diagnóstica con alta sensibilidad y especificidad para hemorragias en el tracto gastrointestinal superior, y también importancia terapéutica, principalmente en el tratamiento de hemorragias por úlcera péptica o várices esofagogástricas.
Colonoscopia: Indicada en pacientes con sospecha de hemorragia gastrointestinal baja o cuando la endoscopia gastrointestinal superior no fue concluyente para identificar el sitio de la hemorragia.
Otras pruebas de imagen: Angiografía mesentérica estándar o angiografía por TC de abdomen y pelvis, gammagrafía con glóbulos rojos marcados y enteroscopia de doble balón o enteroscopia con cápsula endoscópica pueden solicitarse en casos seleccionados, cuando la endoscopia digestiva y la colonoscopia no sean concluyentes. Son especialmente útiles en la evaluación de hemorragias originadas en el intestino delgado.
Úlcera gástrica
- Clasificación de Forrest:
- Forrest I: Sangrado activo (riesgo > 90%):
- Ia: Sangrado en «chorro».
- Ib: Sangrado lento («babeo»).
- Forrest II: Sangrado reciente:
- IIa: Vaso visible sin sangrado (riesgo = 50%).
- IIb: Coágulo visible sin sangrado (riesgo = 30%).
- IIc: Hematina con base ulcerosa (mancha negra) (riesgo = 10%).
- Forrest III: Úlcera de base clara sin signos de sangrado reciente (riesgo < 5%).
- Forrest I: Sangrado activo (riesgo > 90%):
¡Observación! Estimar el riesgo de resangrado.
- Clasificación Sakita:
- A1 (Active): La lesión generalmente presenta bordes planos y nítidos, un fondo con fibrina y, en ocasiones, restos necróticos.
- A2 (Active): Los bordes se tornan bien definidos, a veces elevados, adquiriendo una forma más nítida. Fondo con fibrina espesa y clara.
- H1 (Healing): La fibrina se torna más tenue, comienza una ligera convergencia de pliegues, con hiperemia marginal.
- H2 (Healing): Se notan islas de tejido en regeneración, con clara convergencia de pliegues e hiperemia marginal intensa.
- S1 (Scar): Iniciar la formación de una cicatriz roja con una reacción inflamatoria residual adyacente.
- S2 (Scar): Resolución del cuadro con formación de una cicatriz blanca, con retracción adyacente variable.
Várices esofágicas
Clasificaciones
- En cuanto a la ubicación (clasificación Sarín):
- Várices esofagogástricas tipo 1 (GOV1): Asociación de várices esofágicas con várices gástricas, siguiendo la curvatura menor.
- Várices esofagogástricas tipo 2 (GOV2): Asociación de várices esofágicas con várices gástricas, recorriendo el fondo gástrico.
- Várices esofágicas.
- Várices aisladas del fondo gástrico tipo 1 (IGV1): Várices aisladas del fondo gástrico.
- Várices aisladas del fondo gástrico tipo 2 (IGV2): Várices gástricas ectópicas o en la primera porción del duodeno.
- En cuanto al calibre:
- Delgada: Diámetro hasta 3 mm.
- Mediana: Diámetro entre 3-5 mm o menos de un tercio de la luz del esófago.
- Gruesa: Diámetro mayor a 5 mm o mayor a un tercio de la luz del esófago.
- En cuanto a la apariencia:
- Con manchas rojas.
- Sin manchas rojas.
Diagnóstico diferencial
El diagnóstico diferencial se establece entre las causas de hemorragia digestiva alta:
- Sangrado por úlceras pépticas.
- Sangrado por várices esofagogástricas.
- Síndrome de Mallory-Weiss.
- Lesión aguda de la mucosa.
- Lesión de Dieulafoy.
- Fístula aortoentérica.
- Hemobilia.
- Hemosuccus pancreaticus (hemorragia del conducto Wirsung).
- Ectasia vascular antral.
- Neoplasia gástrica.
Seguimiento
Evaluación pronóstica (aplicada a sangrados ulcerosos)
- Escore de Rockall:
- Propósito: Evaluar el riesgo de resangrado y muerte en pacientes con sangrado ulcerativo.
- Interpretación:
- Menor de 3 puntos: Buen pronóstico.
- Mayor de 8 puntos: Alto riesgo de complicaciones.
- Escore de Glasgow-Blatchford:
- Propósito: Evaluar la necesidad de intervención endoscópica o quirúrgica para controlar el sangrado.
- Interpretación:
- ≥ 6: Alto riesgo de necesitar intervención.
- Los pacientes con escore 0, pueden considerarse para tratamiento ambulatorio.
Factores asociados al riesgo de resangrado en la enfermedad ulcerosa péptica
- Inestabilidad hemodinámica:
- Los pacientes que presentan signos de inestabilidad hemodinámica tienen un mayor riesgo de resangrado.
- Hemoglobina inferior a 10 g/L:
- Una hemoglobina baja al ingreso indica un mayor riesgo de resangrado y necesidad de intervención.
- Sangrado activo en el momento de la endoscopia:
- La presencia de sangrado activo durante la endoscopia es un predictor significativo de resangrado.
- Úlcera mayor de 1-3 cm:
- El tamaño de la úlcera es un factor importante, con úlceras más grandes asociadas a un mayor riesgo de resangrado.
- Localización de la úlcera:
- Úlceras en el bulbo duodenal posterior o en la región superior de la curvatura gástrica menor tienen un mayor riesgo de resangrado debido a la proximidad de vasos sanguíneos importantes.
Factores asociados al riesgo de resangrado en várices esofágicas
- Sangrado activo en el momento de la endoscopia:
- Al igual que en las úlceras, el sangrado activo durante la endoscopia en várices esofágicas es un fuerte predictor de resangrado.
- Child-Pugh mayor que B7:
- Los pacientes con una clasificación de Child-Pugh mayor a B7 (indicativa de una enfermedad hepática avanzada) tienen un riesgo significativamente mayor de resangrado y peores resultados clínicos.
Enfoque terapéutico
Enfoque inmediato
- Estabilización clínica: Estimar la gravedad de la hemorragia:
- Shock hipovolémico: Hipotensión (PAS < 90 mmHg) + disminución del nivel de conciencia + extremidades frías = pérdida de volumen estimada > 40%.
- Taquicardia en reposo + hipotensión postural: Pérdida de volumen estimada del 15-30%;
- Sin hipotensión/sin taquicardia: Pérdida de volumen estimada < 15%.
- ¡Observación! El hematocrito no es un buen parámetro para estimar la pérdida aguda de volumen.
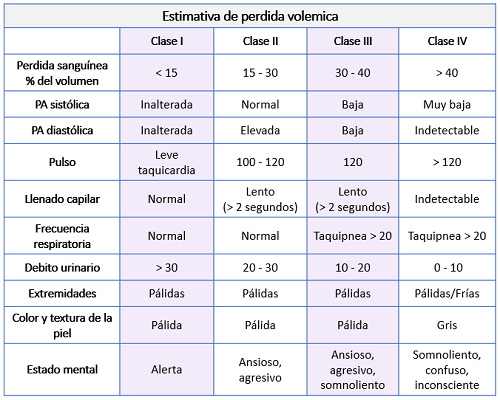
- Reposición volémica: Si la pérdida de volumen > 15%:
- Cristaloides: Dos grandes accesos periféricos; 20-30 ml/kg de SF al 0.9% o Ringer lactato.
- Si pérdida de volumen estimada > 30%: Hemotransfusion (cada concentrado de glóbulos rojos aumenta 0.5-1.0 g/dL de hemoglobina y 3% del hematocrito para un objetivo de 20% en los jóvenes y 30% en los ancianos). Se debe administrar una unidad de plasma por cada 4 unidades de concentrado de glóbulos rojos.
- Monitorización: Monitor cardíaco, PA no invasiva, oximetría, sonda vesical (el mejor parámetro para estimar la perfusión es la diuresis).
- Soporte:
- Oxigenoterapia suplementaria.
- Dieta cero.
- Plasma fresco: 15-20 mL/kg IV: Si INR > 2, pre-procedimiento invasivo o sangrado activo significativo, especialmente en pacientes no cirróticos. Si es necesaria una corrección rápida de la coagulopatía o hay restricción de volumen, se recomienda utilizar un complejo protrombínico. No se recomienda el uso de plasma fresco en el sangrado gastrointestinal por varices en pacientes cirróticos, independientemente del valor de INR.
- Concentrado de plaquetas: 1 unidad/10 kg de peso IV: Si sangrado activo y plaquetas < 50.000/mm3; plaquetas < 10.000/mm3, incluso en ausencia de hemorragia. En pacientes cirróticos, puede considerarse si falla el control de la hemorragia, pero no debe ser una indicación de rutina.
Hemorragia digestiva alta por úlcera péptica
El tratamiento clínico y endoscópico debe guiarse por los hallazgos de la propia endoscopia digestiva alta, determinándose el manejo con base en la clasificación de Forrest.
Tratamiento clínico:
- Iniciar inhibidor de la bomba de protones (IBP) IV, que debe mantenerse durante al menos 3 días, seguido de traslape a via oral:
- Opciones: Pantoprazol u omeprazol 80 mg en bolo intravenoso, seguido de 8 mg/hora de forma continua u omeprazol 40 mg IV cada 12 horas; Esomeprazol 80 mg en bolo IV, seguido de Esomeprazol 40 mg IV cada 12 horas.
- Después de realizar el traslape a vía oral, se debe mantener el uso de IBP cada 12 horas, durante 14 días, y luego reducirlo a 1 vez al día, por la mañana, con el estómago vacío.
- Después de la estabilización hemodinámica, realizar endoscopia digestiva alta, preferiblemente dentro de las primeras 24 horas.
- Transfundir concentrados de glóbulos rojos si la hemoglobina es < 7 g/l. En pacientes con comorbilidades cardíacas y pulmonares graves puede ser necesario mantener la hemoglobina por encima de 8-9 g/L.
- Se puede administrar eritromicina 250 mg IV, 30 minutos antes de la endoscopia, para mejorar la visualización de las lesiones, si está disponible.
- La endoscopia digestiva alta debe repetirse en caso de resangrado. Si la segunda terapia endoscópica falla, se debe considerar la cirugía o el tratamiento endovascular (embolización transarterial).
- Indicar complejo protrombínico en caso de paciente con hemorragia gastrointestinal activa grave y en uso de warfarina.
- Generalmente no se recomienda el lavado gástrico.
- Suspender los medicamentos ulcerógenos (principalmente AINEs).
- Pesquisar y erradicar H. pylori, si está presente (reduce el riesgo de resangrado del 20 % al 3 %). Esquema clásico: Amoxicilina (500 mg) 2 comprimidos cada 12 horas + Claritromicina 500 mg cada 12 horas + Omeprazol 20 mg cada 12 horas, durante 14 días.
Tratamiento endoscópico:
- Indicado para Forrest Ia, Ib, IIa y IIb (riesgo alto o intermedio de resangrado).
Tratamiento quirúrgico:
- Indicaciones:
- Shock refractario a la reanimación con líquidos.
- Falla endoscópico (después de dos intentos).
- Sangrado recurrente después de la estabilización inicial.
- Sangrado continuo, que requiere transfusion > 3 concentrados de glóbulos rojos/día.
Profilaxis secundaria:
- En pacientes con antecedentes de enfermedad ulcerosa péptica que requieran uso continuo de antiagregantes plaquetarios o anticoagulantes orales, se recomienda mantener el inhibidor de la bomba de protones.
Hemorragia digestiva alta de origen varicoso
Abordaje:
- Estabilización hemodinámica: Se debe realizar expansión de volumen con cristaloides en pacientes con hipotensión arterial. Se recomienda la intubación orotraqueal en pacientes con hematemesis activa o alteración del nivel de conciencia, antes de la realizacion de la endoscopia.
- Terapia farmacológica: Comience con una de las siguientes opciones:
- Octreotida (primera elección): Bolo de 50 microgramos IV, seguido de infusión continua de 50 microgramos/hora.
- Terlipresina: 2 mg IV cada 4 horas, reduciéndose a 1 mg cada 4 horas después de controlar el sangrado. La terlipresina está contraindicada en pacientes que presentan hipoxia o deterioro de sintomas respiratorios y en aquellos con isquemia coronaria, periferica o mesenterica en curso.
- Somatostatina: Bolo de 250 mg IV, seguido de infusion continua de 250-500 microgramos/hora.
- La duración del tratamiento es controvertida (de 2-5 días) y tiene como objetivo reducir el riesgo de resangrado precoz. Las últimas directrices indican que es razonable acortar el tratamiento con drogas vasoactivas a 2 días sólo en pacientes seleccionados con cirrosis Child-Pugh A y B, sin sangrado activo identificado durante la endoscopia.
- Transfusión de hemoderivados: En general, la transfusión de concentrado de glóbulos rojos está indicada si la hemoglobina es < 7 g/dl; sin embargo, la indicación de transfusión debe individualizarse, teniendo en cuenta otros factores, como enfermedades cardiovasculares, edad, estado hemodinámico y sangrado continuo. La transfusión de plaquetas y crioprecipitado puede considerarse caso por caso sólo si fracasa el tratamiento clínico-endoscópico de la hemorragia. No se recomiendan el plasma fresco, el factor VIIa recombinante ni el ácido tranexámico.
- Profilaxis antibiótica: Iniciar norfloxacinO 400 mg por vía oral cada 12 horas (Child A con vía oral disponible) o Ciprofloxacino 400 mg IV cada 12 horas (cirrosis Child B) o Ceftriaxona 1 g IV cada 24 horas (cirrosis Child B/C – primera opción) y mantener durante 5 días.
- Considerar lactulosa VO/SNE para la prevención de la encefalopatía hepática.
- Endoscopia digestiva alta: Preferiblemente realizada dentro de las primeras 12 horas posteriores al ingreso hospitalario. Si el paciente está inestable se debe realizar lo antes posible, tan pronto como la seguridad lo permita. Siempre que sea posible, se debe realizar una ligadura elástica de las venas varicosas sangrantes. La escleroterapia también se puede utilizar para controlar el sangrado. Las várices esofágicas tienen más probabilidades de sangrar en la unión gastroesofágica porque son más superficiales en esta ubicación y no pueden descomprimirse a través de la vena ácigos dada la falta de comunicación con las venas periesofágicas.
- Alrededor del 10-20% puede desarrollar un nuevo sangrado a pesar del tratamiento endoscópico. En este caso se debe repetir la endoscopia y, si no es posible un tratamiento adecuado o si hay una nueva recurrencia, se debe evaluar un abordaje quirúrgico o TIPS.
- En pacientes refractarios puede ser necesario insertar un balón de Sengstaken-Blakemore o una prótesis metálica autoexpandible a modo de puente para realizar TIPS. La prótesis metálica es tan efectiva como la de balón y es la opción más segura.
- Varices gástricas: Se deben tratar preferentemente con adhesivos tisulares (cianoacrilato, trombina, etc) en las varices GOV1, GOV2 e IGV. La ligadura elástica se puede utilizar en las venas varicosas GOV1.
- TIPS: Debe ser preferido con respecto al abordaje quirúrgico debido a la alta mortalidad asociada a este último. El TIPS preventivo puede estar indicado en las primeras 72 horas en pacientes con cirrosis infantil CHILD-Pugh mayor a B7 y menor a C14, con sangrado activo en la EDA inicial o con gradiente hepático-venoso > 20 mmHg, considerados de alto riesgo de resangrado:
- La falta de control del sangrado de las várices a pesar del tratamiento farmacológico y endoscópico combinado es una indicación de TIPS de rescate. Los TIPS se consideran inútiles en pacientes con Child-Pugh ≥ C14 o MELD > 30 o lactato > 12 mmol/L, a menos que el trasplante sea una opción breve.
- Las contraindicaciones absolutas para TIPS son: Insuficiencia cardíaca congestiva (estadio C o D, o fracción de eyección documentada < 50%), hipertensión pulmonar grave (PSAP > 45 mmHg), encefalopatía hepática grave no controlada e infección sistémica o sepsis.
- La probabilidad de que un paciente experimente al menos un episodio de encefalopatía hepática después de TIPS varía entre el 30% y el 50%, mientras que la encefalopatía grave e incapacitante ocurre en aproximadamente el 8%. Son factores de riesgo de encefalopatía hepática post-TIPS: Encefalopatía hepática previa, edad avanzada, disfunción hepática grave, disfunción renal, hiponatremia, sarcopenia y gradiente hepático-venoso bajo post-TIPS. Se puede utilizar rifaximina para reducir el riesgo de encefalopatía post-TIPS.
- IBP intravenosos: Cuando un paciente con hipertensión portal llega a urgencias, no es posible determinar si la etiología del sangrado es varicosa o ulcerosa hasta que se realiza una endoscopia. Por este motivo, está indicado el inicio de IBP intravenosos hasta que se aclare el diagnóstico. Si no hay indicación de mantener los IBP, se deben suspender después de la endoscopia.
- Los pacientes con HDA varicosa deben someterse a pruebas de imagen, preferiblemente seccionales (tomografía computarizada o resonancia magnética), para excluir trombosis venosa esplácnica, carcinoma hepatocelular y mapear colaterales portosistémicas.
- Los pacientes que estén usando anticoagulantes deben suspender su uso hasta que el sangrado esté bajo control.
- En pacientes con GOV2, IGV1 o várices ectópicas, la obliteración retrógrada con balón (BRTO) puede considerarse como una alternativa al tratamiento endoscópico o TIPS, si es factible y está disponible.
- La mala nutrición aumenta el riesgo de resultados adversos en pacientes con cirrosis y hemorragia gastrointestinal por varices. La nutrición oral debe reanudarse lo antes posible.
Profilaxis primaria de hemorragia gastrointestinal en pacientes cirróticos:
- Cuándo realizar la detección de várices esofágicas: Los pacientes cirróticos con menos de 150 000 plaquetas o rigidez hepática ≥ 20 kPa en la elastografía no son candidatos para iniciar betabloqueadores para prevenir la descompensación hepática por otros criterios. Actualmente, el uso de betabloqueadores está indicado en cualquier paciente cirrótico compensado con hipertensión portal clínicamente significativa, independientemente de la presencia de várices esofágicas, para prevenir la descompensación hepática, especialmente de las primeras ascitis.
- Los pacientes con cirrosis compensada que utilizan betabloqueadores no requieren screening endoscópico, ya que esto no cambiaría la conducta.
Profilaxis pre-primaria: La profilaxis no está indicada para prevenir la aparición de varices. Generalmente, las várices esofágicas se forman en pacientes con síndrome de hipertensión portal cuando el gradiente venoso hepático supera los 10-12 mmHg.
Profilaxis primaria:
- Reduce el riesgo de primer sangrado.
- Reduce el riesgo de descompensación hepática.
- Puede reducir la mortalidad general en el subgrupo de pacientes que responden al tratamiento con betabloqueadores. Se considera respondedor a un paciente cuyo gradiente venoso hepático cae a menos de 12 mmHg o el 20% del valor inicial.
- Se puede realizar con un betabloqueador o mediante ligadura elástica de varices.
- Indicada en caso de:
- Venas varicosas de cualquier tamaño.
- Betabloqueadores:
- Carvedilol hasta la dosis máxima posible, objetivo de una dosis de 6.25 mg cada 12 horas (primera elección).
- Propranolol en dosis máxima con el objetivo de una frecuencia cardíaca entre 55-60 lpm. Generalmente se inicia con una dosis de 20 mg cada 12 horas.
- Se debe prestar atención a los efectos secundarios del uso de betabloeadores, como hipotensión, pesadillas, broncoespasmo e impotencia. En estos casos está indicada la terapia con ligadura elastica.
- Ligadura elástica: Generalmente reservada para pacientes con várices esofágicas con manchas rojas o de mediano y gran calibre, intolerantes o con contraindicaciones a los betabloqueadores.
- Además del mayor costo, presenta riesgo de sangrado asociado a la formación de úlceras en el sitio de ligadura.
- No reduce el riesgo de otras descompensaciones hepáticas.
- No está indicada la profilaxis primaria con cianoacrilato para las várices del fondo gástrico.
- Tampoco está indicada la profilaxis primaria con TIPS.
Profilaxis secundaria:
- Su objetivo es reducir el riesgo de resangrado.
- La combinación de un betabloqueador no selectivo con ligadura elástica es la mejor opción para la profilaxis secundaria de la hemorragia digestiva alta.
- La ligadura elástica debe realizarse cada 15 días hasta la erradicación, posteriormente cada 6-12 meses.
- Los pacientes que desarrollan hemorragia recurrente deben someterse a TIPS y ser remitidos para un trasplante de hígado.
Prescripción ambulatoria
Profilaxis secundaria del sangrado digestivo superior varicoso
Directrices para el prescriptor. Recomendaciones:
- La profilaxis secundaria de la hemorragia digestiva alta por várices debe realizarse con terapia combinada con betabloqueadores y ligadura elástica periodica.
- Después de la erradicación de las várices esofágicas mediante ligadura elástica, se sugiere repetir la endoscopia digestiva alta anualmente.
- Se debe prestar atención a los efectos secundarios del uso de betabloqueadores, como hipotensión, pesadillas, broncoespasmo e impotencia. En estos casos está indicada la monoterapia con ligadura elástica.
Tratamiento farmacológico:
- Betabloqueador: Elige una de las siguientes opciones:
- Carvedilol (primera elección) (3.125 mg, 6.25 mg/comprimido): Dosis más alta posible hasta un máximo de 6.25 mg cada 12 horas.
- Propranolol (10 mg, 40 mg/comprimido): 20 mg por vía oral cada 12 horas, en ausencia de contraindicaciones. Progresar la dosis hasta alcanzar una frecuencia cardiaca entre 55-60 lpm.
Prescripción hospitalaria
Paciente con criterios de hospitalizacion
Directrices para el prescriptor. Recomendaciones:
- La prioridad en el tratamiento debe ser la estabilización hemodinámica y asegurar la perfusión tisular, seguido del control del sangrado.
- En presencia de hemorragia digestiva alta, se deben suspender los diuréticos y antihipertensivos, incluidos los betabloqueadores.
- Realizar endoscopia digestiva alta dentro de las primeras 12 horas posteriores al ingreso. Si el paciente está inestable, realizarlo tan rápido como lo permita la seguridad del paciente.
- Ante la presencia de sangrado masivo, considerar pasar un balón de Sengstaken-Blakemore o colocar una prótesis metálica autoexpandible.
- En ausencia de indicación para el mantenimiento del inhibidor de la bomba de protones (ej. úlcera péptica asociada), suspender el IBP después de la EDA.
- No está indicado el uso de factor VII recombinante, ácido tranexámico o plasma fresco.
- Evaluar criterios para TIPS preventivos: Child-Pugh < C14 y > B7 con sangrado activo en la endoscopia inicial o gradiente de presión venosa hepática >20 mmHg.
- Realizar imágenes transversales lo antes posible para excluir trombosis en el sistema esplácnico, presencia de carcinoma hepatocelular y evaluar la circulación colateral.
- A partir del quinto día de tratamiento considerar iniciar betabloqueadores para profilaxis secundaria de HDA según prescripción ambulatoria.
Dieta e Hidratación
- Dieta oral cero durante las primeras 24-48 horas.
- Después de la ligadura elástica, dieta blanda fría durante 14 días.
- Hidratación intravenosa: Basada en parámetros hemodinámicos y requerimientos basales del paciente.
Tratamiento farmacológico
- Vasoconstrictor Esplácnico: Elige una de las siguientes opciones:
- Octreotida (0.05, 0.1, 0.5 mg/ml): Bolo de 50 microgramos IV, seguido de infusión continua de 50 microgramos/hora IV, durante 2 a 5 días.
- Terlipresina (0.1 mg/mL): 2 mg en bolo IV, seguido de 2 mg IV cada 4 horas. Reducir a 1 mg IV cada 4 horas después de controlar el sangrado y mantener durante 2 a 5 días.
- Inhibidor de la bomba de protones: Suspender después de la endoscopia si no está indicado. Elige una de las siguientes opciones:
- Pantoprazol: 80 mg en bolo IV, seguido de 8 mg/hora, continuo, durante al menos 3 días; luego desescalar a VO.
- Omeprazol: 40 mg IV cada 12 horas, durante al menos 3 días; luego desescalar a VO.
- Esomeprazol: 40 mg IV cada 12 horas, durante al menos 3 días; luego desescalar a VO.
- Profilaxis Antibiótica: Elige una de las siguientes opciones:
- Norfloxacina: 400 mg VO/SNE cada 12 horas, durante 5 días.
- Ciprofloxacino: 400 mg IV cada 12 horas, durante 5 dias.
- Ceftriaxona: 1 g IV cada 24 horas, durante 5 días: 1ª opción en pacientes con cirrosis avanzada (Child B y C).
- Estabilización hemodinámica: Evaluar las necesidades individuales del paciente:
- Noradrenalina (1 mg/mL): Administrar 0.05-0.1 microgramos/kg/minuto (0.015-0.030 ml/kg/hora) IV por BIC (dosis máxima: 0.5 microgramos/kg/minuto), evaluar según la respuesta.
- Lactulosa (667 mg/mL): Iniciar con 20-40 ml VO/SNE cada 12 horas y ajustar con el objetivo de 2-3 deposiciones/día, si hay signos de encefalopatía hepática.
Tratamiento no farmacológico
- Hemoderivados: Elige una de las siguientes opciones o combínelas según necesidad clínica:
- Concentrado de plaquetas: Considerar transfusión de 1 unidad/10 kg de peso IV, si el sangrado reaparece a pesar de medidas farmacológicas y endoscópicas.
- Concentrado de glóbulos rojos: Mantener Hb > 7 g/dL: En pacientes con enfermedad coronaria o insuficiencia cardíaca, puede ser necesario mantener niveles de hemoglobina más altos.
Cuidado
- Mantenga dos accesos venosos grandes.
Referencias bibliográficas
Laine L, Barkun AN, Saltzman JR, et al. ACG Clinical Guideline: Upper gastrointestinal and ulcer bleeding. Am J Gastroenterol. 2021; 116(5):899-917.
de Franchis R, Bosch J, Garcia-Tsao G, et al. Baveno VII – Renewing consensus in portal hypertension [published correction appears in J Hepatol. J Hepatol. 2022; 76(4):959-974.
Garcia-Tsao G, Abraldes JG, Rich NE, et al. AGA clinical practice update on the use of vasoactive drugs and intravenous albumin in cirrhosis: Expert review. Gastroenterology. 2024; 166(1):202-210.
Lee EW, Eghtesad B, Garcia-Tsao G, et al. AASLD Practice Guidance on the use of TIPS, variceal embolization, and retrograde transvenous obliteration in the management of variceal hemorrhage. Hepatology. 2024; 79(1):224-250.
Kaplan DE, Ripoll C, Thiele M, et al. AASLD Practice Guidance on risk stratification and management of portal hypertension and varices in cirrhosis. Hepatology. 2023.
Sverdén E, Markar SR, Agreus L, et al. Acute upper gastrointestinal bleeding. BMJ. 2018; 363:k4023.
European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018; 69(2):406-460.
Hwang JH, Shergill AK, Acosta RD, et al. The role of endoscopy in the management of variceal hemorrhage. Gastrointest Endosc. 2014; 80(2):221-227.
de Franchis R, Baveno VI Faculty. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015; 63(3):743-752.
Satoh K, Yoshino J, Akamatsu T, et al. Evidence-based clinical practice guidelines for peptic ulcer disease 2015. J Gastroenterol. 2016; 51(3):177-194.
Barkun AN, Almadi M, Kuipers EJ, et al. Management of Nonvariceal Upper Gastrointestinal Bleeding: Guideline Recommendations From the International Consensus Group. Ann Intern Med. 2019; 171(11):805-822.
Sugerencias y comentarios al correo: contacto@galenbook.com

