Actualizado 15 de agosto 2023
Introducción
- De los 200 millones de cirugías que se realizan en todo el mundo cada año, un millón de pacientes muere en el periodo post-operatorio de 30 días.1 Según la definición de complicación cardíaca, el tipo de operación no cardiaca realizada y la población estudiada, las tasas de complicaciones cardiacas pueden ser de hasta 5%.
- Entre quienes presentan un infarto miocárdico (IM) perioperatorio, el riesgo calculado de mortalidad intrahospitalaria es de 10% a 15%.
Fisiopatología
- Los datos de necropsias sugieren que los IM perioperatorios letales ocurren por los mismos mecanismos que los IM no perioperatorios.
- Se han documentado IM tipo 1 (ruptura de placa) y tipo 2 (discrepancia entre el suministro y demanda de oxígeno).
- La distribución entre IM tipo 1 y tipo 2 en el periodo perioperatorio no es del todo clara. Sin embargo, un estudio angiográfico encontró evidencia de ruptura de placa (tipo 1) hasta en 50% de los pacientes que se someten a cirugía no cardiaca.
- La fisiología de la discrepancia entre suministro y demanda de oxígeno, con frecuencia, se relaciona con taquicardia en el periodo perioperatorio. La hipotensión y la anemia también contribuyen a esto
Diagnóstico
Anamnesis
El objetivo de la anamnesis es identificar factores y enfermedades concomitantes que influyan en el riesgo perioperatorio. Se han desarrollado varios modelos para estratificar el riesgo, pero en general, todos se enfocan en reconocer alguna enfermedad cardiovascular conocida o uno de sus factores de riesgo. La provocación de signos y síntomas de cardiopatías es muy importante.
- Evidencia de condición cardiaca activa:
- IM reciente (en los 60 días anteriores, si no hubo intervención coronaria).
- Angina inestable o síndrome coronario agudo.
- Síntomas de insuficiencia cardiaca congestiva (ICC) descompensada.
- Valvulopatía grave.
- Arritmias significativas (no incluye fibrilación auricular crónica con frecuencia controlada).
- Otros factores de riesgo significativos:
- Insuficiencia cardiaca congestiva estable.
- Enfermedad arterial coronaria (EAC) preexistente estable.
- Diabetes mellitus.
- Accidente vascular cerebral o ataque isquémico transitorio previos.
- Cirugía intraabdominal, intratorácica o vascular.
- Insuficiencia renal (creatinina > 1.5 o 2, según el calculador de riesgo).
Exploración física
Es esencial efectuar una exploración física completa y poner atención especial en:
- Signos vitales, sobre todo, presión sanguínea y evidencia de hipertensión.
- Por lo general, se consideran aceptables la presión arterial sistólica (PAS) < 180 y la presión arterial diastólica (PAD) < 110 mmHg, sin aumento significativo del riesgo cardiaco.
- Puede ser razonable retrasar la operación si la PAS es > 180 o la PAD es > 110, si se trata de un nuevo diagnóstico de hipertensión o si hay evidencia de daño orgánico.
- Soplos sugestivos de lesiones valvulares significativas, en especial, estenosis aórtica. Se considera que las lesiones estenóticas sintomáticas, como la estenosis mitral y la estenosis aórtica, conllevan el riesgo más alto.
- Estenosis aórtica.
- La estenosis aortica sintomática grave (superficie valvular < 1.0 cm2 o gradiente medio ≥ 40 mmHg) se relaciona con aumento del IM perioperatorio y la mortalidad en 30 días.
- El riesgo perioperatorio de la estenosis aórtica asintomática, moderada y grave parece menor y no se requiere otra intervención antes de una cirugía electiva de riesgo bajo o alto.
- Estenosis mitral.
- Debe efectuar una comisurotomía percutánea con globo antes de una operación electiva en pacientes con estenosis mitral grave que cumplan con los criterios estándar para la intervención.
- Es posible realizar una operación no cardiaca de riesgo alto en pacientes con estenosis mitral grave asintomática que no cumplen con los criterios para intervención percutánea.
- La insuficiencia mitral y la insuficiencia aórtica sintomáticas, casi siempre, son tolerables en el periodo perioperatorio y pueden tratarse con fármacos.
- Evidencia de insuficiencia cardiaca: Aumento de la presión venosa yugular, estertores, S3, etc.
- En todas las lesiones valvulares significativas es importante que considere la necesidad de profilaxis para endocarditis.
Pruebas diagnósticas
Electrocardiograma de 12 derivaciones
- El electrocardiograma preoperatorio de rutina no está indicado en pacientes asintomáticos antes de una operación de bajo riesgo.
- Los lineamientos de 2014 del American College of Cardiology/American Heart Association (ACC/AHA) incluyen las siguientes recomendaciones:
- Es razonable obtener un ECG preoperatorio en pacientes con EAC conocida, factores de riesgo cardiaco o cardiopatía estructural cuando se someten a una operación de alto riesgo.
- Los pacientes asintomáticos que se someten a una cirugía de alto riesgo pueden beneficiarse de un electrocardiograma basal preoperatorio, pero los estudios tienen resultados contradictorios sobre la utilidad de esto.
Diagnóstico por imagen
- En general, las indicaciones para la evaluación ecocardiográfica en el periodo preoperatorio no son distintas a las de situaciones no quirúrgicas. No siempre es necesario un ecocardiograma.
- Identificar nuevos soplos en la exploración física que sean sugestivos de valvulopatía subyacente significativa sugiere la pertinencia de realizar un ecocardiograma.
- Es fundamental que considere la valoración de la función ventricular izquierda cuando existen dudas clínicas sobre insuficiencia cardiaca congestiva no diagnosticada o agravada o sobre la nueva presencia de disnea de origen desconocido.
Pruebas diagnósticas
La prueba de esfuerzo debe estar guiada por una valoración de riesgo preoperatorio, como se detalla a continuación. Asimismo, la prueba de esfuerzo de rutina no está indicada en todos los pacientes que se someten a cirugía y, en general, no se recomienda para procedimientos no cardiacos de bajo riesgo.
- Prueba de esfuerzo:
- Los pacientes deben ser capaces de caminar en una banda y ejercitarse al 85% de la frecuencia cardiaca máxima prevista.
- El electrocardiograma debe ser interpretable. La presencia de bloqueo de rama izquierda advierte sobre la importancia de cambiar a la prueba de estrés farmacológico.
- Prueba de esfuerzo con electrocardiograma (sin imagen):
- Aunque no se usa con frecuencia, esta prueba todavía puede ser útil.
- No debe haber alteraciones en el electrocardiograma basal que impidan la interpretación de la prueba (ej. carga del ventrículo izquierdo, depresión del segmento ST > 1 mm).
- Prueba de esfuerzo con imágenes (ecocardiograma o perfusión nuclear):
- Ningún diagnóstico por imagen es claramente superior a otro para estratificar el riesgo.
- Debe considerarse la comorbilidad (ej. obesidad que impida las ventanas ecocardiográficas) y las interrogantes adicionales (ej. una valvulopatía que aumente la utilidad de la ecocardiografía) para elegir el estudio diagnóstico.
- Prueba de estrés farmacológico:
- Por lo general, se dispone de imagen por perfusión nuclear con vasodilatador y ecocardiografía con dobutamina.
- Ninguna tiene superioridad clara sobre la otra para estratificar el riesgo.
- Debe considerarse la comorbilidad que vuelve indeseable el uso de un fármaco determinado (ej. dobutamina en las arritmias supraventriculares o adenosina en el broncoespasmo).
Estratificación del riesgo
La American College of Cardiology/American Heart Association (ACC/AHA) publicaron lineamientos revisados para la evaluación y el manejo cardiaco perioperatorio en 2014, los cuales se describen en la figura 1.
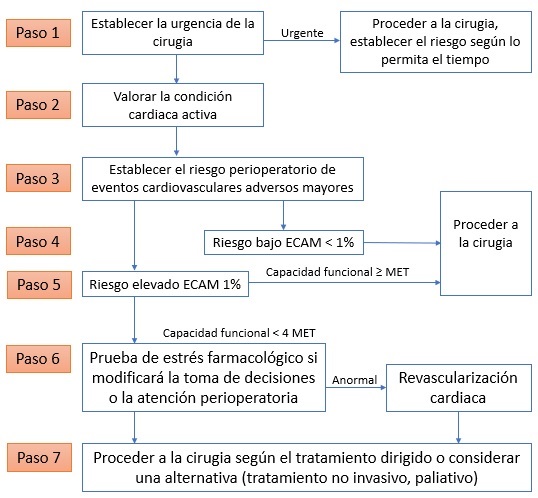
Paso 1: Establecer la urgencia de la intervención quirúrgica.
- La cirugía urgente (menos de 6 horas) no amerita más pruebas.
- Si el tiempo lo permite, debe realizar una evaluación preoperatoria y sugerir estrategias terapéuticas.
- Es importante señalar que aunque muchas operaciones no representan una emergencia absoluta, son urgentes (de 6-24 horas) y es improbable que permitan una evaluación que requiere tiempo.
Paso 2: Valorar la condición cardiaca activa.
- Como se definió antes en la anamnesis:
- Síndrome coronario agudo [Infarto miocárdico con elevación del segmento ST (IMEST), Infarto miocárdico sin elevación del segmento ST (IMNEST), angina inestable, Infarto miocárdico reciente].
- Insuficiencia cardiaca descompensada.
- Valvulopatía grave.
- Arritmias inestables.
- Se recomienda retrasar la operación para dar un tratamiento.
Paso 3: Determinar el riesgo perioperatorio de eventos cardiovasculares adversos mayores.
- Es importante establecer los riesgos de los ECAM en el periodo perioperatorio.
- Los factores de riesgo clínicos se adaptan a partir del Revised Cardiac Risk Index (RCRI):
- Cardiopatía isquémica.
- Antecedente de AIT o ACV.
- Antecedente de ICC.
- Insuficiencia renal (creatinina sérica ≥ 2.0).
- Diabetes mellitus que requiere insulina.
- Riesgo quirúrgico, definido como cirugía intraperitoneal, intratorácica o vascular suprainguinal.
- Los pacientes con 1 o ningún factor de riesgo clínico tienen riesgo bajo (< 0.9%) y puede procederse a la cirugía sin más pruebas.
- Los pacientes con 2 o más factores de riesgo clínicos tienen un riesgo elevado de eventos cardiovasculares adversos, sobre todo, con la cirugía vascular. Es importante tomar en cuenta los riesgos y beneficios de pruebas cardiacas adicionales.
- Es posible que el RCRI no sea una predicción efectiva del riesgo relacionado con la cirugía vascular.
- Las calculadoras de riesgo del National Surgical Quality Improvement Program (NSQIP) del American College of Surgeons (ACS) permiten evaluar mejor el riesgo cardiaco relacionado con la cirugía vascular. Sin embargo, la calculadora de riesgo quirúrgico tiene > 20 entradas de riesgo, lo que puede ser incómodo o inaccesible (http://riskcalculator.facs.org/RiskCalculator/, acceso el 7/IX/16).
Paso 4: Pacientes con riesgo bajo.
- La cirugía de bajo riesgo se define como una operación con un riesgo combinado del paciente y del procedimiento < 1% de ECAM.
- Por lo general, los pacientes pueden someterse a procedimientos de bajo riesgo sin una evaluación adicional.
Paso 5: Evaluación de pacientes con riesgo alto.
- La cirugía de alto riesgo se define como una operación con riesgo del paciente y el procedimiento combinados > 1% de ECAM.
- Los lineamientos perioperatorios de 2014 de AHA/ACC combinaron los procedimientos antes llamados de riesgo intermedio y de riesgo alto en esta categoría debido a las recomendaciones terapéuticas similares.
- Valorar la capacidad funcional del paciente.
- Es improbable que los pacientes con capacidad funcional adecuada, ≥ 4 equivalentes metabólicos de tarea (MET, metabolic equivalents of task), sufran complicaciones cardiovasculares graves y puede procederse a la operación.
- La capacidad funcional deficiente (< 4 MET) se acompaña de un mayor riesgo de eventos cardiovasculares perioperatorios.
- Es posible llevar a cabo un cálculo confiable de la capacidad funcional mediante el informe del propio paciente sobre sus actividades diarias.
- Ver en la tabla 1 los MET de ciertas actividades.

Paso 6: Evaluación de pacientes con riesgo alto y capacidad funcional baja o desconocida.
- Es importante desarrollar un plan para los pacientes con riesgo alto, ICAM > 1% y capacidad funcional deficiente (< 4 MET) o desconocida.
- Es factible indicar la prueba de estrés farmacológico si la información diagnóstica adicional modificará las decisiones terapéuticas.
- Cualquier plan para revascularización preoperatoria debe tomar en cuenta las limitaciones descritas a continuación.
Paso 7: Proceder a la operación en pacientes con riesgo alto.
- Muchos pacientes con riesgo perioperatorio elevado se someten a cirugía sin prueba de estrés farmacológico.
- Es necesario seguir el tratamiento médico dirigido por lineamientos (TMDL) en todos los pacientes, al margen de las pruebas.
- Es fundamental considerar los tratamientos alternativos, como las medidas no invasivas o la paliación, en pacientes con el riesgo más alto de una complicación cardiaca.
Tratamiento
Revascularización
Los mejores datos disponibles sobre la revascularización preoperatoria provienen del estudio CARP, el cual es un estudio prospectivo en pacientes programados para cirugía vascular.
- Todos los pacientes observados tenían EAC significativa que se evidenció en angiografía.
- Los sujetos se distribuyeron al azar para someterse a revascularización [injerto para revascularización arterial coronaria (IRAC) en 41% e intervención coronaria percutánea (ICP) en 59%] o no someterse a la revascularización.
- Las exclusiones notables de la población del estudio fueron los pacientes con compromiso significativo de la coronaria izquierda principal, disfunción del ventrículo izquierdo grave, enfermedad arterial grave y presencia de enfermedades concomitantes severas.
- No hubo diferencia entre los grupos respecto a la incidencia de IM o muerte a los 30 días ni en la mortalidad en el seguimiento prolongado.
- Con base en estos resultados, no se recomienda la revascularización coronaria habitual como método para reducir el riesgo perioperatorio. Es importante que identifique a los subgrupos con riesgo alto que podrían mejorar su supervivencia con la revascularización, al margen de su necesidad de cirugía no cardiaca, según el TMDL.
- Se aplican otras consideraciones más a pacientes que se sometieron a ICP preoperatoria:
- Si se usó una endoprótesis metálica desnuda, la cirugía no cardiaca electiva no debe realizarse en los 30 días siguientes a la ICP. Esto debido al riesgo elevado de estenosis en la endoprótesis.
- La cirugía no cardiaca electiva debe posponerse 12 meses después de colocar endoprótesis liberadoras de fármaco (ELF), sobre todo, si no puede suspenderse el tratamiento antiplaquetario doble antes de la operación. Es razonable considerar una cirugía 6 meses después de colocar una ELF en ciertas circunstancias y luego de discutirlo con el cardiólogo del paciente.
- En caso de angioplastia sola, se recomienda un retraso de 2 semanas.
Tratamiento médico
- Bloqueadores β.
- El interés inicial en el beneficio cardioprotector de los bloqueadores β en el periodo perioperatorio se basa en estudios relativamente pequeños que mostraron un riesgo cardiaco favorable y un beneficio en la mortalidad.
- Sin embargo, diversas investigaciones posteriores notables no demostraron un beneficio claro en pacientes diabéticos que se sometieron a cirugías no cardiacas ni en poblaciones de cirugía vascular.
- Un estudio más reciente, POISE (8351 pacientes), demostró un aumento en la mortalidad total y en los AVC en el grupo terapéutico (metoprolol preoperatorio), a pesar del descenso en los eventos cardiovasculares.
- Las recomendaciones actuales del ACC/AHA para el bloqueo perioperatorio son la siguientes:
- Los bloqueadores β deben continuarse en el periodo perioperatorio para pacientes con tratamiento bloqueador crónico (clase 1).
- Es viable iniciar los bloqueadores β perioperatorios en pacientes con riesgo intermedio o alto de isquemia detectado en la prueba de esfuerzo (IIb), en aquellos con 3 o más factores de riesgo RCRI (IIb) y en los que tienen una indicación crónica para el tratamiento bloqueador β (IIb).
- Si se inicia el tratamiento, los bloqueadores β deben comenzarse > 1 día antes y no el día de la operación.
- Debe ponerse atención a la presencia de cualquier contraindicación del uso de bloqueadores β.
- Agonistas α2: Con base en el estudio POISE-2, no hay indicación para iniciar agonistas α2 en el periodo perioperatorio para una cirugía no cardiaca. Estos fármacos no redujeron el riesgo de infarto miocárdico no letal o muerte, pero sí se incrementaron el paro cardiaco no letal y la hipotensión.
- Estatinas: Los estudios actuales sugieren un beneficio probable con el uso perioperatorio de estatinas.
- Se demostró un descenso en la mortalidad intrahospitalaria con el uso de estatinas en un estudio de cohorte retrospectivo de pacientes sometidos a diversas operaciones mayores no cardiacas.
- Una cohorte retrospectiva que evaluó las estatinas en cirugía no cardiaca ni vascular mostró un descenso en la mortalidad a 30 días en el grupo terapéutico.
- Recomendaciones actuales:
- Las estatinas deben continuarse en el periodo perioperatorio en pacientes que las toman como tratamiento crónico.
- Las personas que se someten a cirugía vascular podrían beneficiarse del inicio de una estatina en el periodo perioperatorio.
- El tratamiento con estatina puede iniciarse en el periodo perioperatorio en pacientes que se someten a procedimientos de alto riesgo, si está indicado en el tratamiento dirigido por lineamiento.
- Ácido acetilsalicílico.
- Lo usual es suspender el ácido acetilsalicílico ~1 semana antes de someterse a procedimientos invasivos para minimizar el riesgo hemorrágico.
- Sin embargo, cierta evidencia sugiere que la suspensión de este fármaco en pacientes con endoprótesis vasculares puede relacionarse con un mayor riesgo de eventos cardiovasculares.
- El estudio POISE-2 no demostró un beneficio cardiaco en la mortalidad con el inicio perioperatorio de ácido acetilsalicílico, pero identificó un riesgo más alto de hemorragia mayor en el grupo terapéutico.
- Recomendaciones:
- En general, no se recomienda iniciar ni continuar el ácido acetilsalicílico para prevenir eventos cardiovasculares en pacientes sin una endoprótesis cardiaca que se some-ten a operaciones no cardiacas y no carotídeas. Sin embargo, puede considerarse si el riesgo de isquemia miocárdica es mayor que el riesgo hemorrágico.
- Cualquier decisión sobre el cambio en el tratamiento antiplaquetario del paciente con ICP reciente (< 30 días endoprótesis metálica desnuda, < 365 días ELF) debe tomarse en coordinación con el cardiólogo del paciente y los cirujanos, con base en el riesgo de hemorragia y trombosis en la endoprótesis.
Seguimiento
Los lineamientos actuales del ACC/AHA recomiendan:
- Obtener un electrocardiograma en los pacientes con signos clínicos o síntomas de isquemia miocárdica o arritmia.
- Se sugiere la medición de la troponina sólo en pacientes con signos clínicos o síntomas de infarto miocárdico.
- No hay indicación para mantener la vigilancia en ausencia de signos o síntomas de isquemia miocárdica.
(Ver – Evaluación pulmonar preoperatoria)
Referencias bibliográficas
Weiser TG, Regenbogen SE, Thompson KD, et al. An estimation of the global volume of surgery: a modelling strategy based on available data. Lancet 2008;372:139-44.
Van Waes JA, Nathoe HM, de Graaff JC, et al. Myocardial injury after noncardiac surgery and its association with short-term mortality. Circulation 2013;127:2264-71.
Adesanya AO, de Lemos JA, Greilich NB, et al. Management of perioperative myocardial infarction in noncardiac surgical patients. Chest 2006;130:584-96.
Dawood MM, Gutpa DK, Southern J, et al. Pathology of fatal perioperative myocardial infarction: implications regarding pathophysiology and prevention. Int J Cardiol 1996;57:37-44.
Gualandro DM, Campos CA, Calderaro D, et al. Coronary plaque rupture in patients with myocardial infarction after noncardiac surgery: frequent and dangerous. Atherosclerosis 2012;222:19-5.
Landesberg G, Beattie WS, Mosseri M, et al. Perioperative myocardial infarction. Circulation 2009;119:2936-44.
Howell SJ, Sear JW, Foex P. Hypertension, hypertensive heart disease and perioperative cardiac risk. Br J Anaesth 2004;92:570-83.
Agarwal S, Rajamanickam A, Bajaj NS, et al. Impact of aortic stenosis on postoperative outcomes after noncardiac surgeries. Circ Cardiovasc Qual Outcomes 2013;6:193-200.
Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines. J Am Coll Cardiol 2014;64:e77-137.
Calleja AM, Dommaraju S, Gaddam R, et al. Cardiac risk in patients aged >75 years with asymptomatic, severe aortic stenosis undergoing noncardiac surgery. Am J Cardiol 2010;105:1159-63.
Van Klei WA, Bryson GL, Yang H, et al. The value of routine preoperative electrocardiography in predicting myocardial infarction after noncardiac surgery. Ann Surg 2007;246:165-70.
Lee TH, Marcantonio ER, Mangione CM, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999;100:1043-9.
Devereaux PJ, Goldman L, Cook DJ, et al. Perioperative cardiac events in patients undergoing noncardiac surgery: a review of the magnitude of the problem, the pathophysiology of the events and methods to estimate and communicate risk. CMAJ 2005;173:627-34.
Ford MK, Beattie WS, Wijeysundera DN. Systematic review: prediction of perioperative cardiac complications and mortality by the revised cardiac risk index. Ann Intern Med 2010;152: 26-35.
Gupta PK, Gupta H, Sundaram A, et al. Development and validation of a risk calculator for prediction of cardiac risk after surgery. Circulation 2011;124:381-7.
Cohen ME, Ko CY, Bilimoria KY, et al. Optimizing ACS NSQIP modeling for evaluation of surgical quality and risk: patient risk adjustment, procedure mix adjustment, shrinkage adjustment, and surgical focus. J Am Coll
Surg 2013;217:336-46, e1.
Reilly DF, McNeely MJ, Doerner D, et al. Self-reported exercise tolerance and the risk of serious perioperative complications. Arch Intern Med 1999;159:2185-92.
Hlatky MA, Boineau RE, Higginbotham MB, et al. A brief self-administered questionnaire to determine functional capacity (the Duke Activity Status Index). Am J Cardiol 1989;64:6514.
Myers J, Bader D, Madhavan R, et al. Validation of a specific activity questionnaire to estimate exercise tolerance in patients referred for exercise testing. Am Heart J 2001;142:1041-6.
McFalls EO, Ward HB, Moritz TE, et al. Coronary-artery revascularization before elective major vascular surgery. N Engl J Med 2004;351:2795-804.
Kaluza GL, Joseph J, Lee JR, et al. Catastrophic outcomes of noncardiac surgery soon after coronary stenting. J Am Coll Cardiol 2000;35:1288-94.
Wilson SH, Fasseas P, Orford JL, et al. Clinical outcome of patients undergoing non-cardiac surgery in the two months following coronary stenting. J Am Coll Cardiol 2003;42:234-40.
Berger PB, Kleiman NS, Pencina MJ, et al. Frequency of major noncardiac surgery and subsequent adverse events in the year after drug-eluting stent placement results from the EVENT (Evaluation of Drug-Eluting Stents and Ischemic Events) Registry. JACC Cardiovasc Interv 2010;3:920-7.
Holcomb CN, Graham LA, Richman JS, et al. The incremental risk of noncardiac surgery on adverse cardiac events following coronary stenting. J Am Coll Cardiol 2014;64:2730-9.
Yang H, Raymer K, Butler R, et al. The effects of perioperative beta-blockade: results of the Metoprolol after Vascular Surgery (MaVS) study, a randomized controlled trial. Am Heart J 2006;152:983-90.
Brady AR, Gibbs JS, Greenhalgh RM, et al. Perioperative beta-blockade (POBBLE) for patients undergoing infrarenal vascular surgery: results of a randomized double-blind controlled trial. J Vasc Surg 2005;41:602-9.
Juul AB, Wetterslev J, Gluud C, et al. Effect of perioperative beta blockade in patients with diabetes undergoing major non-cardiac surgery: randomised placebo controlled, blinded multicentre trial. BMJ 2006;332:1482.
Group PS, Devereaux PJ, Yang H, et al. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. Lancet 2008;371:1839-47.
Devereaux PJ, Sessler DI, Leslie K, et al. Clonidine in patients undergoing noncardiac surgery. N Engl J Med 2014;370:1504-13.
Lindenauer PK, Pekow P, Wang K, et al. Lipid-lowering therapy and in-hospital mortality following major noncardiac surgery. JAMA 2004;291:2092-9.
Raju MG, Pachika A, Punnam SR, et al. Statin therapy in the reduction of cardiovascular events in patients undergoing intermediate-risk noncardiac, nonvascular surgery. Clin Cardiol 2013;36:456-61.
Durazzo AE, Machado FS, Ikeoka DT, et al. Reduction in cardiovascular events after vascular surgery with atorvastatin: a randomized trial. J Vasc Surg 2004;39:967-75.
Desai H, Aronow WS, Ahn C, et al. Incidence of perioperative myocardial infarction and of 2-year mortality in 577 elderly patients undergoing noncardiac vascular surgery treated with and without statins. Arch Gerontol Geriatr 2010;51:149-51.
Ferrari E, Benhamou M, Cerboni P, et al. Coronary syndromes following aspirin withdrawal: a special risk for late stent thrombosis. J Am Coll Cardiol 2005;45:456-9.
Devereaux PJ, Mrkobrada M, Sessler DI, et al. Aspirin in patients undergoing noncardiac surgery. N Engl J Med 2014;370:1494-503.
Sugerencias y comentarios al correo: contacto@galenbook.com

