Actualizado 19 septiembre 2023
Definición
La enfermedad pulmonar obstructiva crónica (EPOC) se define como una obstrucción persistente del flujo de aire resultante de un proceso inflamatorio crónico de los alvéolos y las vías respiratorias pequeñas.
Fisiopatología
La enfermedad pulmonar obstructiva cronica es una afección heterogénea, cuya patogénesis implica la afectación de las vías respiratorias (bronquitis crónica y bronquiolitis), el parénquima pulmonar (enfisema) y la vasculatura pulmonar. Es el resultado de la respuesta inflamatoria exacerbada del tejido pulmonar, ante la exposición a gases y partículas nocivas, junto con factores individuales, como la predisposición genética, la presencia de otras comorbilidades, la prematuridad y la infección respiratoria previa.
Cada vez más existe el concepto de interacción entre la carga genética, la exposición ambiental y el momento de la lesión. Conocida como GETomic (Genetics, Environment, Time), esta interacción adquiere cada vez más importancia en el desarrollo de la enfermedad pulmonar obstructiva cronica.
Vías aereas:
Las alteraciones en las vías aereas incluyen inflamación crónica con infiltración de macrófagos y linfocitos CD8, hipertrofia de glándulas mucosas y metaplasia de células caliciformes, disfunción ciliar, fibrosis tisular, estrechamiento y reducción del número de vías aereas y ademas colapso de las vías aereas debido a la pérdida de anclaje causada por la destrucción de paredes alveolares.
Parénquima pulmonar:
Las alteraciones en el parénquima incluyen un proceso inflamatorio crónico con infiltración de macrófagos y linfocitos CD8, activación de proteasas y estrés oxidativo, que conduce a la destrucción del parénquima, las membranas alveolares y de los acinos.
Vasculatura:
Las alteracion en la vasculatura pulmonar incluyen hiperplasia/hipertrofia de la íntima y del músculo liso de los vasos, asociada con la pérdida de capilares pulmonares debido a la destrucción del parénquima.
Presentación clínica
Cuadro clínico
La disnea, la tos crónica y la expectoración son los tres síntomas principales resultantes de la enfermedad pulmonar obstructiva cronica. La presencia de estos síntomas en pacientes con factores de riesgo como el tabaquismo, la exposición al humo y a partículas nocivas debe hacer sospechar de EPOC.
Importante: La disnea es un síntoma subjetivo y muchas veces no es apreciado por el paciente debido al estilo de vida sedentario. A menudo se describe como cansancio, dificultad para respirar, jadeos, malestar en el pecho y sensación de opresión. Los fumadores o exfumadores no valoran la tos crónica, refiriéndose a ella como algo inherente al acto de fumar. Es imprescindible realizar una anamnesis dirigida en estos casos.
Examen físico
El paciente suele presentar un examen físico normal al inicio de la enfermedad y entre las exacerbaciones.
Examen de tórax: La presencia de enfisema puede evidenciarse por hiperinsuflación pulmonar, disminución de los ruidos respiratorios y cardíacos. El tiempo espiratorio prolongado y las sibilancias son evidencia de obstrucción del flujo aéreo.
Otros hallazgos:
- Uso de músculos accesorios durante la inspiración.
- Ortopnea.
- Cianosis.
- Asterixis por hipercapnia.
- Caquexia.
Las manchas amarillas en los dedos debido a la acumulación de nicotina y alquitrán son indicativas de tabaquismo pesado.
Importante: Las acropaquias digitales (dedos en palillos de tambor) no son típicas de la EPOC y deberían sugerir otro diagnóstico o comorbilidad (cáncer de pulmón, fibrosis pulmonar, bronquiectasias, miocardiopatía congénita).
Indicaciones de enfermedad grave:
- Tórax en tonel (torax en barril): Aumento del diámetro anteroposterior.
- Diafragma rectificado que aumenta el timpanismo a la percusión pulmonar.
Factores de riesgo
Factores ambientales:
- Tabaquismo activo o pasivo.
- Exposición al humo de la quema de combustibles.
- Exposición ocupacional.
- Polucion ambiental.
Factores individuales:
- Predisposición genética (deficiencia de alfa-1-antitripsina).
- Asma e hiperreactividad bronquial.
- Nacimiento prematuro.
- Infecciones respiratorias recurrentes.
Enfoque diagnóstico
El diagnóstico de la enfermedad pulmonar obstructiva cronica debe considerarse en todos los pacientes con factores de riesgo y sintomas sugerentes. Si estos están presentes, se debe solicitar una espirometría, que es fundamental para el diagnóstico. Es importante enfatizar que la enfermedad pulmonar obstructiva cronica tambien se puede presentar en pacientes no fumadores, especialmente en mujeres con factores de riesgo ambientales como la polucion ambiental en países en desarrollo.
Las pruebas de laboratorio de rutina no son necesarias para el diagnóstico inicial de la EPOC, pero pueden usarse para identificar otras causas de disnea o enfermedades concomitantes, además de ayudar a identificar el perfil exacerbador.
Exámenes complementarios
Pruebas de laboratorio:
- Hemograma completo (evaluación de eosinófilos).
- Creatinina.
- TGO, TGP.
- Glicemia en ayunas.
- Perfil lipidico.
- Uroanalisis.
Importante: La medicion de BNP es interesante para evaluar insuficiencia cardíaca, en casos de duda diagnóstica.
Monitorización peak flow (PEF): Aunque habitualmente se utiliza en el diagnóstico y seguimiento del asma, su uso es limitado en la EPOC, ya que tiende a subestimar el grado de obstrucción del flujo aéreo en esta enfermedad.
Volúmenes pulmonares y capacidad de difusión de monóxido de carbono: Esta no es una prueba indicada de rutina para el diagnóstico de la EPOC, sin embargo, puede ser útil para establecer la presencia de enfisema (baja capacidad de difusión) e hiperinsuflación pulmonar (aumento del volumen residual).
Radiografía de tórax: No está indicado de forma rutinaria para la evaluación diagnóstica de la EPOC debido a su baja sensibilidad. Sin embargo, suele solicitarse por su utilidad para excluir diagnósticos diferenciales y comorbilidades. Está indicado durante un episodio de exacerbación aguda, para la evaluación de neumonía y otras complicaciones de la enfermedad (neumotórax).
Cambios esperados en la radiografía de tórax:
- Hipertransparencia pulmonar con desdibujamiento de las estructuras vasculares.
- Hiperinsuflación pulmonar.
- Área cardiaca estrecha en la incidencia frontal.
- Contorno diafragmático plano y aumento del espacio retroesternal en la incidencia lateral.
- En la hipertensión pulmonar con cor pulmonale avanzado se observa un aumento del área cardíaca (principalmente en la incidencia lateral, con reducción del espacio retroesternal) y una prominencia de los vasos hiliares.
Tomografía de tórax: Al igual que la radiografía de tórax, no es una recomendación de rutina para el diagnóstico, pero puede considerarse ante la presencia de exacerbaciones agudas para evaluar complicaciones pulmonares (infección, neumotórax, bulas gigantes). Además, la mayoría de los pacientes con sospecha o diagnostico de EPOC son fumadores o exfumadores, y la tomografia de tórax está indicada para detectar nódulos pulmonares.
Gasometría arterial: Indicado en pacientes con VEF1 < 50%, saturación de oxígeno en oximetría de pulso < 92%, pacientes con disminucion del nivel de conciencia y en exacerbación aguda de la EPOC. Importante en este contexto para la evaluación de acidosis, hipoxemia e hipercapnia, e indicación de oxígeno suplementario. Un aumento en la concentración sérica de bicarbonato puede indicar hipercapnia crónica, lo que refleja un proceso compensatorio en el riñón.
Alfa-1-antitripsina: Debe solicitarse en todo paciente diagnosticado con EPOC, según GOLD. Los signos sugestivos son: Presentación temprana (< 45 años) y ausencia de factores de riesgo clásicos.
Prueba de caminata de 6 minutos: Indicador sensible de la capacidad funcional cardiopulmonar del paciente, siendo utilizado como marcador precoz de pronóstico y evaluación de la respuesta terapéutica.
Ecocardiograma: Indicado para evauar hipertensión pulmonar y utilizado en el diagnóstico diferencial de causas de disnea.
Espirometria: Prueba de función pulmonar:
- Indicación: Para todos los pacientes con sospecha clínica de EPOC para confirmación diagnóstica, evaluación pronóstica del grado de limitación del flujo aéreo, seguimiento de la respuesta al tratamiento y progresión de la enfermedad.
- Objetivo: Demostrar la limitación del flujo aéreo y la ausencia de reversibilidad mediante la prueba broncodilatadora mediante la maniobra de volumen espirado forzado.
- Alteraciones esperadas: El diagnóstico de la EPOC se confirma cuando hay una relación VEF1/CVF (índice de Tiffeneau) < 0.7 después de la prueba broncodilatadora. La EPOC suele asociarse con un VEF1 < 80% de lo previsto, en ausencia de cualquier otra razón para los síntomas y la obstrucción del flujo aéreo.
- Volumen espiratorio forzado en un segundo (VEF1): Corresponde al volumen movilizado en el primer segundo de la maniobra de volumen espirado forzado.
- Capacidad vital forzada (CVF): Representa el volumen total espirado en una maniobra forzada, es decir, con el mayor esfuerzo posible del paciente.
- Relación VEF1/CVF: El trastorno obstructivo provoca una reducción más pronunciada del VEF1 que de la CVF, reduciendo la relación entre ambos. El diagnóstico de obstrucción se da por la relación < 0.7 después de la prueba broncodilatadora.
- Prueba broncodilatadora: Después de 400 microgramos de Salbutamol y un intervalo de 10 minutos, se repite la maniobra y se evalúa la diferencia entre las curvas y valores. Si hay un aumento de 200 mL y una variación superior al 12% en el VEF1 o un aumento de 350 mL en la CVF, significa que el paciente tiene una respuesta broncodilatadora positiva.
- PRISm (Preserved Ratio Impaired Spirometry): Pacientes que presentan VEF1 y/o CVF < 80% del valor previsto, después de la prueba broncodilatadora, pero que mantienen el índice > 0.7. Se trata de pacientes que no han sido diagnosticados de EPOC pero que tienen riesgo de desarrollar la enfermedad, especialmente aquellos con factores de riesgo.
Clasificación
Durante muchos años, la EPOC se consideró una enfermedad única asociada con el tabaquismo. Con el avance de los estudios se propone clasificarlo según su etiopatogenia.
Clasificación taxonómica
Se proponen siete categorías:
- EPOC-G: Geneticamente determinada, asociada con deficiencia de alfa-1-antitripsina y otras condiciones genéticas.
- EPOC-D: Desarrollo pulmonar inadecuado, asociado a prematuridad, bajo peso al nacer y/o eventos en el recién nacido.
- EPOC ambiental:
- EPOC-C: Asociada con el consumo de cigarrillos, tabaquismo, cigarrillos electrónicos y cannabis.
- EPOC-P: Asociado a la contaminación y exposición ambiental a humos y quema de combustibles fósiles.
- EPOC-I: Asociado a infecciones como tuberculosis.
- EPOC-A: Asociada con asma.
- EPOC-U: Asociada a causas desconocidas (en ingles, unknown).
Clasificación del grado de obstrucción de las vías respiratorias
Según la espirometría, el paciente se clasifica en:
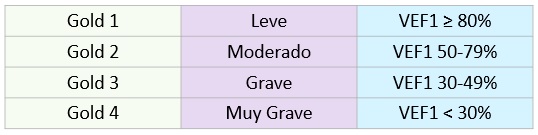
Clasificación funcional del paciente
La gravedad de los síntomas se evalúa mediante las escalas CAT (CPOD Assessment Tool ) o mMRC (modified Medical Research Council).
Escala CAT: Escala de evaluacion sintomática para pacientes con EPOC, en la que se evalúan ocho parámetros puntuados del 1 al 5 según el grado de intensidad de los síntomas:
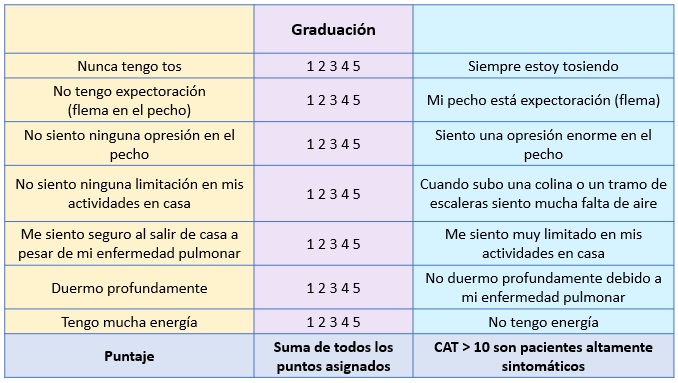
Índice de disnea mMRC modificado :
- Grado 0: Tengo falta de aire cuando realizo ejercicio intenso.
- Grado 1: Tengo falta de aire cuando apresuro el paso, subo escaleras o cuestas.
- Grado 2: A veces tengo que detenerme cuando camino a mi ritmo o camino más lento que otras personas de mi edad.
- Grado 3: Tengo que parar muchas veces por falta de aire cuando camino cerca de 100 metros o unos minutos de caminata en plano.
- Grado 4: Me falta tanto aire que no salgo de casa o necesito ayuda para vestirme o ducharme.
Clasificación en Grupos
El principal cambio en el último consenso GOLD 2023 fue la clasificación en grupos. En lugar de clasificar al paciente en ABCD, ahora se debería clasificar en un perfil exacerbante y no exacerbante. Dentro del grupo de los no exacerbantes, existen los grupos A y B separados por síntomas:
- Grupo A – bajo riesgo: Oligosintomático; típicamente GOLD 1 o GOLD 2 (limitación del flujo de aire leve o moderada) y 0-1 exacerbaciones por año y ninguna hospitalización por exacerbaciones; Puntuación CAT <10 o mMRC 0-1.
- Grupo B – bajo riesgo: Polisintomático; típicamente GOLD 1 o GOLD 2 (limitación del flujo de aire leve o moderada) y 0-1 exacerbaciones por año y ninguna hospitalización por exacerbaciones; Puntuación CAT ≥ 10 o mMRC ≥ 2.
- Grupo E – alto riesgo: Perfil exacerbador, que tiene 2 o más exacerbaciones por año o 1 hospitalización por exacerbación.
Importante: Estas clasificaciones tienen como objetivo establecer:
- Gravedad de la obstrucción.
- Deterioro de la calidad de vida.
- Riesgo futuro de exacerbaciones.
Estos tres elementos guiarán la propuesta terapéutica.
Diagnóstico diferencial
El diagnóstico diferencial se establece con otras causas de obstrucción del flujo aéreo y disnea de esfuerzos en adultos:
- Bronquitis crónica con espirometría normal (puede desarrollar EPOC).
- Asma (puede coexistir asma y EPOC. Según el GOLD 2022, no existe un síndrome de superposición, sino que pueden coexistir enfermedades diferentes. En estos casos se debe seguir el protocolo de asma).
- Tuberculosis.
- Bronquiectasias.
- Estenosis de las vía aérea central: Disfunción de las cuerdas vocales, cuerpo extraño, tumor en la vía aerea, compresión extrínseca u obstrucción endobronquial.
- Bronquiolitis obliterante.
- Panbronquiolitis difusa.
- Linfangioleiomiomatosis.
- Insuficiencia cardíaca.
Seguimiento
Seguimiento ambulatorio: El tratamiento debe controlarse cada 3 meses al inicio hasta un control sintomático adecuado.
Las causas más comunes de falla en el tratamiento son:
- Falta de adherencia al tratamiento.
- Mantenimiento de la exposición ambiental (tabaquismo y polución).
- Uso incorrecto de dispositivos de inhalación.
- Trastornos psicosociales.
Indicaciones de hospitalización:
La mayoría de las exacerbaciones de la EPOC no requieren hospitalización, sin embargo, se recomienda el ingreso si alguno de estos factores está presente:
- Disnea que empeora progresivamente.
- Presencia de cianosis, reducción del estado mental, edema periférico.
- VEF1 ≤ 50% de lo previsto.
- Historial de exacerbaciones frecuentes u hospitalizaciones por exacerbaciones de la enfermedad.
- Comorbilidades como arritmia cardíaca, insuficiencia cardíaca, diabetes mellitus, insuficiencia hepática, insuficiencia renal.
- Apoyo domiciliario insuficiente.
- Estado general frágil.
Factores pronósticos:
La sobrevida del paciente se relaciona principalmente con el valor VEF1, ya que representa la gravedad de la disfunción pulmonar. Sin embargo, la presencia de los siguientes factores empeora el pronóstico:
- Tabaquismo.
- Hiperreactividad de las vías aéreas.
- IMC ≤ 21.
- Infección por VIH.
- Carga bacteriana aumentada en las vías respiratorias.
- Capacidad de ejercicio disminuida.
- Bajo pico de consumo de O2 (VO2), medido mediante la prueba de ejercicio cardiopulmonar.
- Proteína C reactiva > 3 mg/L.
- Tomografía computarizada de tórax que muestra enfisema pulmonar.
- Género masculino.
Atención primaria
Los objetivos del tratamiento de la enfermedad pulmonar obstructiva crónica son prevenir y tratar las complicaciones y exacerbaciones., desacelerar su progresión, aliviar los síntomas y aumentar la tolerancia al ejercicio.
En la mayoría de los casos, el seguimiento de la EPOC se puede realizar en la atención primaria de salud.
Pasos para alcanzar los objetivos del tratamiento:
- Evaluar y monitorear la EPOC:
- Determinar la gravedad de la enfermedad, evaluando la evolución de los síntomas (evaluar la disnea cada 2-3 meses).
- Realizar una espirometría anual para identificar el empeoramiento de la función pulmonar.
- Evaluar a los pacientes con mayor riesgo de exacerbaciones (mayor riesgo para aquellos con >2 exacerbaciones/año).
- Reducir los factores de riesgo:
- Dejar de fumar, utilizando un abordaje adecuado por parte del médico de familia (intervención breve, entrevista motivacional, etc).
- Descartar otros factores de riesgo.
- Manejar la EPOC estable y sus exacerbaciones.
Cuándo derivar al paciente al especialista:
- En caso de duda diagnóstica.
- Sospecha de EPOC grave (VEF1 < 30% de lo previsto).
- Sospecha de cor pulmonale.
- Rápida disminución del VEF1.
- SatO2 < 92% en reposo y/o a los esfuerzos.
- Exacerbaciones frecuentes.
- EPOC < 40 años.
Enfoque terapéutico
Medidas no farmacológicas
- Cesar el tabaquismo y/o la exposición ambiental.
- Actualización de la vacunación contra influenza, neumococo, covid-19, dTPa (difteria/tétanos/tos ferina).
- Rehabilitación pulmonar y actividad física.
- Uso de ventilación mecánica no invasiva (CPAP o BiPAP) para pacientes con hipercapnia grave y hospitalización reciente.
- Oxigenoterapia para pacientes con PaO2 < 55 mmHg o < 60 mmHg con cor pulmonale y/o policitemia asociada.
- Tratamiento de comorbilidades asociadas.
Medidas farmacológicas
- Objetivos: Reducir el número de exacerbaciones, mejorar la sintomatología, aumentar la tolerancia al ejercicio, mejorar la calidad de vida y disminuir la pérdida de función pulmonar.
- Broncodilatadores: Actúan sobre la musculatura lisa de los bronquios, mejorando el VEF1 y reduciendo la hiperinsuflación pulmonar:
- Beta-2 agonista: Actúan sobre los receptores adrenérgicos, provocando un aumento del AMPc y relajación del músculo liso. Pueden ser de corta duración, conocidos como SABA (short-acting B2 agonist), o de larga duración, conocidos como LABA (long-acting B2 agonist).
- Antimuscarínicos: Actúan bloqueando el receptor muscarínico (M3) en el músculo liso bronquial, impidiendo el efecto broncoconstrictor de este receptor. Pueden ser de corta duración, conocidos como SAMA (short-acting muscarinic antagonist), o de larga duración, conocidos como LAMA (long-acting muscarinic antagonist).
- Metilxantinas: Probable efecto inhibidor de la fosfodiesterasa (PD4), provocando broncodilatación.
- Agentes antiinflamatorios: Actúan previniendo y/o tratando las exacerbaciones.
- Corticoide inhalado: Actúa sobre la respuesta inflamatoria local, reduciendo el número de exacerbaciones. Sin embargo, algunos estudios lo correlacionan con un mayor riesgo de neumonía.
- Corticoide oral: Su uso a largo plazo genera más daño que beneficio, reservándose sólo para periodos de exacerbación.
- Inhibidores PD4: Los inhibidores de la fosfodiesterasa (Romiflulast) actúan en la reducción de la degradación del AMPc, reduciendo asi las exacerbaciones.
- Antibiótico: Los macrólidos, principalmente Azitromicina y Eritromicina, tienen efecto antiinflamatorio y se asocian con una menor frecuencia de exacerbaciones. Sin embargo, se relacionan con un aumento de la resistencia bacteriana.
- Mucolíticos y antioxidantes: El uso de N-acetilcisteína en pacientes que no usaron corticoides inhalados se asoció con menos exacerbaciones. Sin embargo, los resultados no son consistentes y no existe ninguna recomendación formal.
Manejo de paciente estable
Ante un paciente con enfermedad pulmonar obstructiva cronica confirmada debemos establecer el grado de obstrucción (1, 2, 3, 4) y si el paciente es exacerbador o no (A, B, E).
Importante: Revise siempre la técnica de uso de los dispositivos. El mal uso de estos es una de las principales causas de exacerbación y mal control de los síntomas. Muchas veces es necesario cambiar el dispositivo por otro que el paciente sienta más cómodo y seguro de utilizar.
- Campaña antitabaquismo: Cada contacto médico es una oportunidad para invitar a su paciente a dejar de fumar. No debemos perder la oportunidad de introducir, fomentar e incentivar el abandono del hábito de fumar.
- Rehabilitación pulmonar: En todas las categorías, en pacientes estables, se beneficia la fisioterapia respiratoria y la rehabilitación pulmonar.
Grupo A
Se debe iniciar un broncodilatador de acción corta o de acción prolongada. El broncodilatador de acción corta, debe usarse bajo demanda y no de forma regular y continuada. Para uso regular se recomienda el broncodilatador de acción prolongada (LABA o LAMA) y el de acción corta como rescate.
Grupo B
Se debe iniciar la combinación LABA + LAMA. Si no hay posibilidad de doble terapia (generalmente por accesibilidad), no hay superioridad entre LABA o LAMA, iniciándose cualquiera de los dos.
Grupo E
Se debe iniciar la combinación LABA + LAMA. Para pacientes con antecedentes de exacerbaciones y/o más de 300 eosinófilos en el hemograma, se debe iniciar el tratamiento con la asociación de corticoides inhalados.
Corticoides inhalados en la EPOC
A diferencia del asma, en la EPOC los corticoides inhalados no son para todos los pacientes. Está fuertemente indicado en pacientes exacerbadores (al menos 2 exacerbaciones por año y/o 1 hospitalización) y eosinófilos > 300 células/microlitro, o con antecedentes de asma. En pacientes con 1 exacerbación por año y eosinófilos > 100, se puede considerar el uso de corticoides inhalados.
Importante: Los corticoides inhalados están contraindicados en pacientes con antecedentes de neumonía recurrente, infección por micobacterias y eosinófilos < 100. Si se utilizan, debe ser asociado con una terapia broncodilatadora dual (LABA + LAMA).
Manejo del paciente disneico
- Según el GOLD, existen dos perfiles principales de pacientes con EPOC:
- 1. Paciente disneico.
- 2. Paciente exacerbador.
- El seguimiento debe basarse en la sintomatología, independientemente de la clasificación inicial.
- En pacientes que ya utilizan LABA o LAMA en monoterapia se debe asociar un segundo broncodilatador, evolucionando a terapia dual. Si la disnea persiste, se debe considerar el uso de triple terapia en pacientes con eosinófilos en sangre > 300 o > 100 pero con antecedentes de más de 2 exacerbaciones leves o 1 exacerbación grave.
- Es fundamental revisar la técnica de inhalación y se podrá considerar el intercambio de dispositivos o medicamentos.
- En pacientes con paO2 < 55 mmHg o 60 mmHg con cor pulmonale o policitemia, está indicado el uso de O2 domiciliario .
- En pacientes hipercápnicos estables está indicado el uso de VNI domiciliaria.
- También es posible evaluar la cirugía de reducción volumétrica o la colocación de una válvula endobronquial.
- Optimizar las comorbilidades asociadas.
Manejo del paciente exacerbador
- En el paciente exacerbador, se debe considerar más tempranamente la asociación de corticoides inhalados. Según GOLD, se desaconseja el uso de broncodilatadores en monoterapia con corticoides inhalados (ej. LABA + corticoides inhalados). Los pacientes con EPOC que se benefician de corticoides inhalados deben recibir dos broncodilatadores de acción prolongada. Son, por lo tanto, pacientes que se benefician de la triple terapia. Si no existen criterios para el uso de corticoides inhalados, el tratamiento debe ser con LABA + LAMA.
- En pacientes en triple terapia que presentan signos de bronquitis crónica y VEF1 < 50%, se debe considerar el uso de Roflumilast.
- En pacientes exfumadores sometidos a triple terapia que mantenga la exacerbación se debe considerar el uso de Azitromicina como antiinflamatorio.
- Si los pacientes continúan exacerbando y experimentan neumonía recurrente, es importante considerar la posibilidad de suspender los corticoides inhalados.
Manejo del paciente refractario
- Medidas quirúrgicas: En pacientes con enfisema grave asociado a hiperinsuflación, refractario al tratamiento clínico, puede estar indicado el tratamiento con válvulas endobronquiales o cirugía de reducción volumétrica pulmonar. La elección entre una técnica y otra depende de la homogeneidad del enfisema y de la presencia o no de ventilación colateral. En presencia de bulas, se puede considerar la bulectomía.
- Trasplante: Los pacientes refractarios al tratamiento clínico, que no sean candidatos a tratamiento quirúrgico, deben ser remitidos para trasplante de pulmón. Se debe considerar el trasplante de pulmón en pacientes con VEF1 < 20%, con DLCO < 20% (prueba de difusión de monóxido de carbono) con o sin cor pulmonale, uso de oxigenoterapia y hospitalización previa con hipoxemia severa. El trasplante puede ser mono o bilateral, y la supervivencia es mayor en el bilateral.
- Cuidados paliativos: Como cualquier enfermedad crónica, la EPOC puede evolucionar con refractariedad al tratamiento y terminalidad. En estos casos, el seguimiento con el equipo de cuidados paliativos es fundamental, con el objetivo no sólo de controlar los síntomas, sino también de definir el plan terapéutico del paciente.
Indicaciones de oxigenoterapia en la EPOC
- Criterios para oxigenoterapia domiciliaria:
- PaO2 < 55 mmHg en aire ambiente o SatO2 < 88%, con o sin hipercapnia, confirmada al menos dos veces en un intervalo de 3 semanas.
- PaO2 < 60 mmHg o SatO2 < 88% en aire ambiente y signos de hipertensión pulmonar.
Nota: La cantidad de O2 debe ser en Litro/minuto suficiente para mantener la SatO2 por encima del 90%. Reevaluar en 60-90 días si ha habido mejoría del cuadro y si aún es necesaria la oxigenoterapia.
Prescripción ambulatoria
Recomendaciones generales
- La interrupción del tabaquismo la principal medida a adoptar para reducir la progresión de la enfermedad.
- La definición del grupo del paciente (A, B, E) es fundamental para iniciar un tratamiento adecuado.
- El escalonamiento de las terapias es hecho con base en los síntomas y las exacerbaciones, independientemente del grupo inicial.
- Se debe informar a cada paciente sobre la rehabilitación pulmonar, la vacunación y la prevención de la exposición.
- En toda consulta se debe evaluar la técnica de uso de los dispositivos.
- Ofrecer el uso de espaciadores con dispositivos de inhalación por aerosol.
- La elección del medicamento debe hacerse en función de su disponibilidad, efectos adversos y rentabilidad.
Tratamiento: Grupo A
Tratamiento farmacológico
Elija uno de los siguientes esquemas a continuación para iniciar el tratamiento.
Esquema A: Broncodilatador de acción corta para rescate de acción corta: Elija una de las siguientes opciones:
- Bromhidrato de fenoterol gotas(5 mg/mL): 2-8 gotas (0.5-2 mg) diluidas en 3 mL de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromhidrato de fenoterol inhalador(100 microgramos/dosis): 1-2 puff inhalados cada 6 horas.
- Salbutamol gotas (5 mg/ml): 10 a 20 gotas (2.5 a 5 mg) diluidas en 3 ml de SF al 0.9% por nebulización hasta cada 6 horas.
- Salbutamol inhalador (100 microgramos/dosis): 1-2 puff inhalados cada 6 horas.
- Bromuro de ipratropio gotas (0.25 mg/ml) 0.5 mg (40 gotas) diluidos en 3 ml de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromuro de ipratropio inhalador (25 microgramos/dosis): 2 puff por inhalación hasta cada 6 horas.
- Bromuro de ipratropio + Bromhidrato de fenoterol inhalador (25/50 microgramos/dosis): 2 puff inhalados en caso de dificultad para respirar y hasta 4 puff seguidos con un intervalo de 5 minutos entre dosis (máximo 8 puff/día).
Esquema B: Broncodilatador de larga acción en monoterapia (LABA o LAMA). Elija una de las siguientes opciones:
- Fumarato de formoterol en capsula para inhalación (12 microgramos/dosis): 12-24 microgramos (1-2 cápsulas) por inhalación cada 12 horas.
- Xinafoato de salmeterol inhalador (25 microgramos/dosis): 2 puff por inhalación cada 12 horas.
- Bromuro de tiotropio cápsula para inhalación (2.5 microgramos/dosis) 2 inhalaciones cada 24 horas.
- Maleato de indacaterol capsulas para inhalar (150 microgramos/dosis): 150 – 300 microgramos (1-2 cápsulas) inhalados cada 24 horas.
- Clorhidrato de olodaterol (2.5 microgramos/dosis) 5 microgramos (2 dosis) inhalados cada 24 horas.
- Bromuro de glicopirronio (50 microgramos/dosis) 50 microgramos (1 cápsula) inhalados cada 24 horas.
- Bromuro de umeclidio (62.5 microgramos/dosis) 62.5 microgramos (1 dosis) por inhalación cada 24 horas.
Tratamiento: Grupo B
Tratamiento farmacológico
Elija uno de los siguientes esquemas a continuacion:
- Esquema A: En este caso serán dos dispositivos. Uno para LABA y otro para LAMA. Asociacion:
- LABA + LAMA + Broncodilatador de accion corta para rescate.
Opciones de LABA (beta-2 agonista de acción prolongada):
- Fumarato de formoterol capsulas para inhalacion (12 microgramos/dosis): 12-24 microgramos (1-2 cápsulas) por inhalación cada 12 horas.
- Xinafoato de salmeterol inhalador (25 microgramos/dosis): 2 puff inhalados cada 12 horas.
- Maleato de indacaterol capsulas para inhalacion (150 microgramos/dosis): 150-300 microgramos (1-2 cápsulas) inhalados cada 24 horas.
- Clorhidrato de olodaterol (2.5 microgramos/dosis) 5 microgramos (2 dosis) inhalados cada 24 horas.
Opciones de LAMA (antimuscarínico de acción prolongada):
- Bromuro de tiotropio (2.5 microgramos/dosis): 2 puff inhalados cada 24 horas.
- Bromuro de glicopirronio capsulas para inhalacion (50 microgramos/dosis): 50 microgramos (1 cápsula) inhalados cada 24 horas.
- Bromuro de umeclidio (62.5 microgramos/dosis): 62.5 microgramos (1 dosis) inhalados cada 24 horas.
Opciones de broncodilatadores de acción corta para rescate:
- Bromhidrato de fenoterol gotas (5 mg/mL) 2-8 gotas (0.5 a 2 mg) diluidas en 3 mL de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromhidrato de fenoterol inhalador (100 microgramos/dosis): 1-2 puff inhalados hasta cada 6 horas.
- Sulfato de salbutamol inhalador (100 microgramos/dosis): 1-2 puff inhalados cada 6 horas.
- Sulfato de salbutamol gotas (5 mg/ml) 0.5-1 ml (10-20 gotas) diluidos en 3-5 ml de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromuro de ipratropio gotas (0.25 mg/ml) 0.5 mg (40 gotas) diluidos en 3 ml de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromuro de ipratropio inhalador (25 microgramos/dosis): 2 puff inhalados hasta cada 6 horas.
- Bromuro de ipratropio + Bromhidrato de fenoterol inhalador (20/50 microgramos/dosis): 2 puff inhalados en caso de dificultad para respirar y hasta 4 puff seguidos con un intervalo de 5 minutos entre dosis (máximo 8 puff/día).
- Esquema B: Uso de un solo dispositivo: Asociación:
- Dos broncodilatadores de acción prolongada (LAMA + LABA) + Broncodilatador de acción corta para rescate.
Opciones de dos broncodilatadores de acción prolongada (LAMA + LABA):
- Bromuro de tiotropio + Clorhidrato de olodaterol (2.5 microgramos + 2.5 microgramos): 5 microgramos (2 puff) inhalados cada 24 horas.
- Bromuro de umeclidinio + Trifenatato de vilanterol (62.5 microgramos + 25 microgramos): 1 puff inhalado cada 24 horas.
- Maleato de indacaterol + Bromuro de glicopirronio (110 microgramos + 50 microgramos): 1 cápsula inhalada cada 24 horas.
Opciones de broncodilatadores de acción corta para rescate: Elija una de las siguientes opciones:
- Bromhidrato de fenoterol gotas(5 mg/mL) 2-8 gotas (0.5-2 mg) diluidas en 3 mL de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromhidrato de fenoterol inhalador (100 microgramos/dosis) 1-2 puff inhalados hasta cada 6 horas.
- Sulfato de salbutamol inhalador (100 microgramos/dosis): 1-2 puff inhalados hasta cada 6 horas.
- Sulfato de salbutamol gotas (5 mg/ml) 0.5-1 ml (10-20 gotas) diluidos en 3-5 ml de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromuro de ipratropio gotas (0.25 mg/ml) 0.5 mg (40 gotas) diluidos en 3 ml de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromuro de ipratropio (25 microgramos/dosis): 2 puff inhalados hasta cada 6 horas.
- Bromuro de ipratropio + Bromhidrato de fenoterol inhalador (20/50 microgramos/dosis): 2 puff inhalados en caso de dificultad para respirar y hasta 4 puff seguidos con un intervalo de 5 minutos entre dosis (máximo 8 puff/día).
Tratamiento: Grupo E
Tratamiento farmacológico
Los estudios mostraron mayor beneficio en un solo dispositivo debido a una mayor adherencia al tratamiento. Elija uno de los siguientes esquemas:
- Esquema A: Asociación:
- Combinación de dos broncodilatadores de acción prolongada (LABA + LAMA) + Broncodilatador de acción corta para rescate.
Opciones de broncodilatadores de acción prolongada: Combinación de LABA + LAMA:
- Opciones de LABA (beta-2 agonista de acción prolongada):
- Fumarato de formoterol capsulas para inhalación (12 microgramos/dosis): 12-24 microgramos (1-2 cápsulas) por inhalación cada 12 horas.
- Xinafoato de salmeterol inhalador (25 microgramos/dosis): 2 puff inhalados cada 12 horas.
- Maleato de indacaterol capsulas para inhalación (150 microgramos/dosis): 150-300 microgramos (1-2 cápsulas) inhalados cada 24 horas.
- Clorhidrato de olodaterol (2.5 microgramos/dosis) 5 microgramos (2 dosis) inhalados cada 24 horas.
- Opciones de LAMA (antimuscarínico de acción prolongada):
- Bromuro de tiotropio (2.5 microgramos/dosis): 2 puff inhalados cada 24 horas.
- Bromuro de glicopirronio capsulas para inhalación (50 microgramos/dosis): 50 microgramos (1 cápsula) inhalados cada 24 horas.
- Bromuro de umeclidio (62.5 microgramos/dosis): 62.5 microgramos (1 dosis) inhalados cada 24 horas.
- Opciones LAMA + LABA en un solo dispositivo:
- Bromuro de tiotropio + Clorhidrato de olodaterol (2.5 microgramos + 2.5 microgramos) 5 microgramos (2 inhalaciones) inhalados cada 24 horas.
- Bromuro de umeclidinio + Trifenatato de vilanterol (62.5 microgramos + 25 microgramos): 1 inhalación cada 24 horas.
- Maleato de indacaterol + bromuro de glicopirronio capsulas para inhalación (110 microgramos + 50 microgramos): 1 cápsula inhalada cada 24 horas.
Opciones de broncodilatadores de acción corta para rescate: Elija una de las siguientes opciones:
- Bromhidrato de fenoterol gotas (5 mg/mL): 2-8 gotas (0.5-2 mg) diluidas en 3 mL de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromhidrato de fenoterol inhalador (100 microgramos/dosis): 1-2 puff inhalados hasta cada 6 horas.
- Sulfato de salbutamol inhalador (100 microgramos/dosis): 1-2 puff inhalados hasta cada 6 horas.
- Sulfato de salbutamol gotas (5 mg/ml): 0.5-1 ml (10-20 gotas) diluidos en 3-5 ml de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromuro de ipratropio gotas (0,25 mg/ml): 0.5 mg (40 gotas) diluidos en 3 ml de SF al 0.9% por nebulización hasta cada 6 horas.
- Bromuro de ipratropio inhalador (25 microgramos/dosis): 2 puff inhalados hasta cada 6 horas.
Esquema B: En pacientes con eosinófilos > 300 células/microlitro o más de 100 células/microlitro con antecedentes de exacerbación grave y/o asma asociada. Asociación:
- LAMA (antimuscarínico de acción prolongada) + LABA (beta-2 agonista de acción prolongada) + IC (corticoide inhalado) .
Opciones Antimuscarínicos de acción prolongada: Elija una de las siguientes opciones:
- Bromuro de tiotropio inhalador (2.5 microgramos/dosis) 2 puff inhalados cada 24 horas.
- Bromuro de glicopirronio capsulas para inhalación (50 microgramos/dosis): 50 microgramos (1 cápsula) inhalados cada 24 horas.
- Bromuro de umeclidio (62.5 microgramos/dosis): 62.5 microgramos (1 dosis) por inhalación cada 24 horas.
Opciones de beta-2 agonistas de acción prolongada: Elija una de las siguientes opciones:
- Fumarato de formoterol capsula para inhalación (cápsula de 12 microgramos/dosis): 12-24 microgramos (1-2 cápsulas) inhalados cada 12 horas.
- Xinafoato de salmeterol inhalador (25 microgramos/dosis): 2 puff inhalados cada 12 horas.
- Maleato de indacaterol capsulas para inhalación (150 microgramos/dosis): 150-300 microgramos (1-2 cápsulas) inhalados cada 24 horas.
- Clorhidrato de olodaterol (2.5 microgramos/dosis): 5 microgramos (2 dosis) inhalados cada 24 horas.
Opciones de combinación de antimuscarínicos de acción prolongada y beta-2 agonistas de acción prolongada: Elija una de las opciones:
- Bromuro de tiotropio + Clorhidrato de olodaterol (2.5 microgramos + 2.5 microgramos): 5 microgramos (2 inhalaciones) inhalados cada 24 horas;
- Bromuro de umeclidinio + Trifenatato de vilanterol (62.5 microgramos + 25 microgramos): 1 inhalación cada 24 horas.
- Maleato de indacaterol + Bromuro de glicopirronio capsulas para inhalación (110 microgramos + 50 microgramos): 1 cápsula inhalada cada 24 horas.
Opciones de corticoides inhalados:
- Budesonida (200-400 microgramos/dosis): 1-2 cápsulas por inhalación cada 12 horas.
- Dipropionato de beclometasona (200 microgramos/dosis): 1-2 puff inhalados cada 12 horas.
- Propionato de fluticasona (50-250 microgramos/dosis): 1-2 puff inhalados cada 12 horas.
Opciones combinadas de CI + LAMA + LABA:
- Furoato de fluticasona + Bromuro de umeclidinio + Trifenatato de vilanterol (100 microgramos + 62.5 microgramos + 25 microgramos): 1 inhalación cada 24 horas.
- Dipropionato de beclometasona + Fumarato de formoterol + Bromuro de glicopirronio (100 microgramos + 6 microgramos + 12.5 microgramos): 2 inhalaciones cada 12 horas.
Seguimiento del tratamiento
El seguimiento del tratamiento farmacológico es según la sintomatología. Los pacientes se dividen didácticamente en dos perfiles:
- Disneico.
- Exacerbador.
Paciente disneico
Pacientes en monoterapia con broncodilatadores:
- Asociar un segundo broncodilatador de acción prolongada, manteniendo LABA + LAMA como terapia continua asociado a un broncodilatador de acción corta como rescate.
Paciente en terapia dual con LABA + LAMA:
- Evaluar el cambio de dispositivos para una mejor adaptación.
- Optimizar el tratamiento no farmacológico:
- Técnica de inhalación.
- Fisioterapia respiratoria.
- BIPAP y CPAP.
- Oxígeno suplementario.
- Investigar otras causas asociadas a la disnea.
- Evaluar abordaje quirúrgico o colocación de válvula endobronquial.
Paciente exacerbador
Paciente en monoterapia broncodilatadora:
- Asociar broncodilatador de acción prolongada en terapia dual (LABA + LAMA).
- Asociar corticoides inhalados cuando esté indicado.
- Considere suspender los corticoides inhalados en caso de neumonía recurrente.
- Evaluar la asociación de Roflumilast en pacientes con VEF1 < 50% y bronquitis crónica.
- Evaluar asociación con azitromicina 500 mg 3 veces por semana en pacientes exfumadores.
Enfermedad refractaria y/o grave
- Evaluar el uso de suplementación de oxígeno domiciliario.
- En pacientes estables está indicado el uso de CPAP o BIPAP domiciliaria.
- Evaluar derivación para trasplante de pulmón.
- Referir a cuidados paliativos.
(Ver – VM en EPOC)
Referencias bibliográficas
Qaseem A, Wilt TJ, Weinberger SE, et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Ann Intern Med. 2011; 155(3):179-191.
Traver GA, Cline MG, Burrows B. Predictors of mortality in chronic obstructive pulmonary disease. A 15 year followup study. Am Rev Respir Dis. 1979; 119(6):895-902.
Halbert RJ, Natoli JL, Gano A, et al. Global burden of COPD: systematic review and meta-analysis. Eur Respir J. 2006; 28(3):523-532.
Broaddus VC, Ernst JD, Lazarus SC, et al. Murray and Nadel’s Textbook of Respiratory Medicine. 6th ed. Philadelphia: Saunders, 2016.
GOLD. Global strategy for the diagnosis, management and prevention of Chronic Obstructive Pulmonary Disease – 2022 Report. [Internet]. Global Initiative for Chronic Obstructive Lung Disease. WI, Fontana-On-Geneva Lake: Global Initiative for Chronic Obstructive Lung Disease Inc. (Accessed on March 03, 2023).
Buist AS, McBurnie MA, Vollmer WM, et al. International variation in the prevalence of COPD (the BOLD Study): a population-based prevalence study. Lancet. 2007; 370(9589):741-750.
Brusasco V, Martinez F. Chronic obstructive pulmonary disease. Compr Physiol. 2014; 4(1):1-31.

