Actualizado 23 marzo 2023
Clase
- Antianemico.
Mecanismo de acción
- La carboximaltosa férrica es un hidróxido de hierro coloidal (III) en complejo con la carboximaltosa, un polímero carbohidrato que libera el hierro necesario para el funcionamiento de la hemoglobina, la mioglobina y sistemas enzimáticos específicos; permite el transporte de oxígeno a través de la hemoglobina.
Presentación
- Solución inyectable: 50 mg/ml (vial de 10 ml).
Uso clínico
- Tratamiento de pacientes con deficiencia de hierro cuando las preparaciones orales de hierro no son efectivas o no pueden usarse.
Dosis
- Adultos:
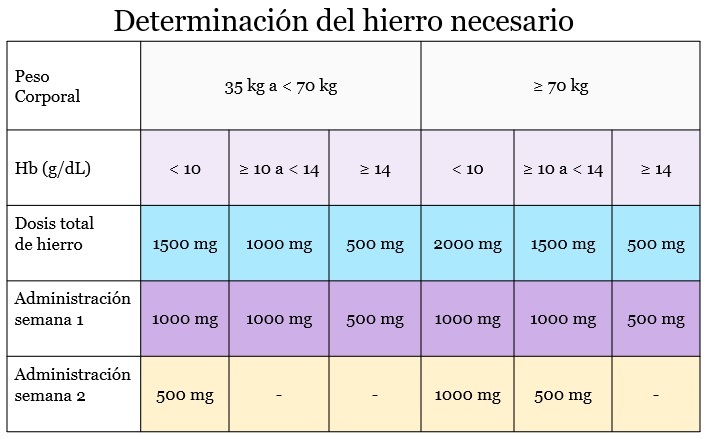
- Nivel de hemoglobina < 10 g/dL:
- 35-70 kg: Dosis acumulada de 1.500 mg IV.
- ≥ 70 kg: Dosis acumulada de 2000 mg IV.
- Nivel de hemoglobina ≥ 10 a < 14 g/dL:
- 35-70 kg: Dosis acumulada de 1000 mg IV.
- ≥ 70 kg: Dosis acumulada de 1.500 mg IV.
- Nivel de hemoglobina ≥ 14 g/dL:
- 35-70 kg: Dosis acumulada 500 mg IV.
- ≥ 70 kg: Dosis acumulada de 500 mg IV.
- < 35 kg: La dosis acumulada no debe exceder los 500 mg de IV.
- Dosis única máxima tolerada: No debe exceder los 1.000 mg de hierro 20 mL/día o 20 mg de hierro 0.4 mL/kg. No administrar 1.000 mg de hierro (20 mL) más de 1 vez por semana.
- Instrucciones de uso: Inyección en bolo IV (no diluida) ó infusión IV.
- Dilución: Infusión IV:
- 2-4 mL + 50 mL SF al 0.9%.
- > 4-10 mL en 100 mL de SF al 0.9% (tiempo de administración: 6 minutos).
- > 10-20 mL en 250 mL de SF al 0.9% (tiempo de administración: 15 minutos).
- Nivel de hemoglobina < 10 g/dL:
Nota: La dosis adecuada, forma de administración, frecuencia y duración del tratamiento debe establecerse teniendo en cuenta los parámetros hematológicos de la deficiencia de hierro.
Seguimiento
- Hemoglobina y hematocrito, ferritina sérica, saturación de transferrina, fosfato sérico (en pacientes con riesgo de hipofosfatemia que requieran tratamiento repetido).
- Signos vitales.
- Controle los signos y síntomas de hipersensibilidad (controle durante ≥ 30 minutos después del final de la administración y hasta la estabilidad clínica).
- Vigile el sitio de infusión por extravasación.
- Enfermedad renal crónica: Controle la saturación de transferrina y ferritina con más frecuencia después de un curso de hierro endovenoso. A los pacientes con deficiencia de hierro se les debe evaluar la ferritina sérica de 2 a 4 semanas después de completar el ciclo de infusión, si no se alcanza la ferritina sérica > 50-100 nanogramos/mL, se debe administrar otra dosis de hierro.
Uso geriátrico
- Medicamento sin restricciones documentadas en ancianos.
Uso en el embarazo
- Categoría B: Utilizar con precaución. Los estudios en animales no han demostrado riesgo fetal.
Uso en lactancia
- Riesgo no determinado. Los datos sobre un número limitado de mujeres lactantes indican que es poco probable que el fármaco suponga un riesgo para los niños.
Uso perioperatorio
- No hay datos en la literatura que recomienden la suspensión y el retorno. Evaluar cada caso.
Uso por sonda nasogástrica/nasoenteral
- No se aplica.
Pediatría
- No existen estudios de seguridad en la población pediátrica.
Ajuste de dosis
- Insuficiencia hepática: Administrar solo después de una cuidadosa evaluación de riesgo-beneficio.
- Hemodiálisis: No exceder una dosis única diaria máxima inyectable de 200 mg de hierro.
Efectos adversos
- Dolor de cabeza.
- Mareo.
- Hipertensión.
- Náuseas.
- Reacción en el sitio de aplicación (inyección/perfusión).
- Rubor.
- Alteraciones de laboratorio: Hipofosfatemia .
Contraindicaciones
- Hipersensibilidad a los componentes.
- Cualquier tipo de anemia no causada por deficiencia de hierro.
- Situaciones de sobrecarga de hierro o trastornos en el uso del hierro.
Advertencias
- Las preparaciones de hierro administradas por vía intravenosa pueden causar reacciones de hipersensibilidad, incluidas reacciones anafilactoides, que pueden ser fatales. Por lo tanto, debe estar disponible el apoyo para la reanimación cardiopulmonar. Si se producen reacciones de hipersensibilidad o signos de intolerancia durante la administración, el tratamiento debe interrumpirse inmediatamente.
- También se informaron reacciones de hipersensibilidad después de dosis previas sin eventos de cualquier complejo de hierro parenteral, incluida la carboximaltosa de hierro. Se debe observar a cada paciente en busca de efectos adversos durante al menos 30 minutos después de cada aplicación de este medicamento.
- Los preparados de hierro administrados por vía parenteral pueden causar hipofosfatemia, que en la mayoría de los casos es transitoria y sin síntomas clínicos. Se han reportado casos ocasionales de hipofosfatemia que requirieron atención médica, principalmente en pacientes con factores de riesgo preexistentes y luego de exposición prolongada a altas dosis de hierro intravenoso.
- Se han notificado casos de hipofosfatemia que dieron lugar a osteomalacia hipofosfatémica y fracturas que requirieron intervención clínica, incluida cirugía. Los pacientes deben ser derivados a un médico si experimentan artralgia o dolor óseo.
- Los pacientes que reciben múltiples dosis altas para el tratamiento a largo plazo y con factores de riesgo subyacentes (como deficiencia de vitamina D, malabsorción de calcio y fosfato, hiperparatiroidismo secundario, telangiectasia hemorrágica hereditaria, enfermedad inflamatoria intestinal y osteoporosis) deben ser monitoreados por osteomalacia hipofosfatémica. En caso de hipofosfatemia persistente, se debe reevaluar el tratamiento con carboximaltosa de hierro.
- Los preparados de hierro intravenosos deben utilizarse con precaución en caso de infección aguda o crónica, asma, eccema o alergia atópica. Se recomienda suspender la administración de este fármaco en pacientes con bacteriemia. En pacientes con infección crónica se debe realizar una evaluación riesgo-beneficio, considerando la supresión de la eritropoyesis por infección crónica.
- Se debe tener cuidado para evitar extravasamiento venoso durante la administración, ya que esto puede causar una decoloración marrón potencialmente duradera e irritación de la piel en el lugar de la inyección. Si ocurre, la administración debe suspenderse inmediatamente.
- La solución de carboximaltosa contiene 0.24 mmol (o 5.5 mg) de sodio por ml de solución sin diluir equivalente al 0.3 % de la dosis máxima diaria de 2 g de sodio para un adulto recomendada por la Organización Mundial de la Salud (OMS).
- La solución de carboximaltosa también contiene un máximo de 75 microgramos de aluminio por mililitro de solución sin diluir. Esto debe tenerse en cuenta al tratar a pacientes sometidos a diálisis.
- Debe evitarse la administración parenteral de hierro en pacientes con insuficiencia hepática, en particular en pacientes con porfiria cutánea tardía, en los que la sobrecarga de hierro es un factor precipitante. Se recomienda un control cuidadoso de los niveles de hierro para evitar la sobrecarga de hierro.
- No administrar 20 ml (1000 mg de hierro) en inyección o infusión más de una vez a la semana.
Farmacocinética
- Absorción: No aplicable.
- Distribución: El volumen de distribución del compartimiento central corresponde al volumen de plasma (aproximadamente 3 L).
- Metabolismo: La carboximaltosa de hierro se retiene principalmente en el sistema reticuloendotelial de la médula ósea, el hígado y el bazo.
- Eliminación: El hierro de la carboximaltosa férrica se elimina rápidamente del plasma; en un estudio, la vida media terminal osciló entre 7 y 12 horas y el tiempo medio de residencia osciló entre 11 y 17 horas. La eliminación renal de hierro fue insignificante.
Referencias bibbliográficas
Ferric carboxymaltose: Drug Information. Lexicomp Online, Pediatric and Neonatal Lexi-Drugs Online. Hudson, Ohio: Wolters Kluwer Clinical Drug Information Inc., 2022.
Ferinject (ferric carboxymaltose). Adriano Costa Leite. São Paulo: Blanver Farmoquímica e Farmacêutica S.A., 2022. Package insert.
Sugerencias y comentarios al correo: contacto@galenbook.com

