Actualizado 10 noviembre 2023
Definición
La enfermedad celíaca es una enteropatía autoinmune crónica del intestino delgado, desencadenada por la exposición al gluten (la principal fracción proteica presente en el trigo, el centeno y la cebada) en individuos genéticamente predispuestos
Fisiopatología
El gluten ingerido por personas genéticamente predispuestas provoca una respuesta inflamatoria en la mucosa intestinal.
La transglutaminasa tisular, presente en la mucosa intestinal, elimina los radicales amina de las moléculas de glutamina del gluten, transformándolas en ácido glutámico.
Este tiene afinidad por las moléculas HLA-DQ2 y DQ8, presentes en la superficie de las células presentadoras de antígenos.
La formación de este complejo induce cambios fenotípicos en varias células implicadas en la respuesta inmune, responsables de los cambios intestinales y sistémicos de la enfermedad.
Presentación clínica
Epidemiología: Prevalencia del 0.5-2% de los individuos en la mayoría de los estudios. Se estima que alrededor de 1 de cada 474 adultos y 1 de cada 184 niños tienen enfermedad celíaca no diagnosticada. La enfermedad es más prevalente entre las mujeres, a una tasa de 2 mujeres por cada 1 hombre, y en los países de latitudes más elevadas. Más del 70% de los pacientes son diagnosticados después de los 20 años.
Los pacientes con mayor riesgo de enfermedad celíaca son:
- Familiares de primer grado (padres y hermanos) de pacientes con enfermedad celíaca.
- Anemia por deficiencia de hierro refractaria al reemplazo de hierro por vía oral.
- Reducción de la densidad mineral ósea (osteopenia y osteoporosis).
- Retraso puberal o baja estatura sin causa aparente.
- Pacientes con enfermedades autoinmunes, como diabetes mellitus tipo I, tiroiditis autoinmune, deficiencia selectiva de IgA, síndrome de Sjögren, miocarditis autoinmune, enfermedades hepáticas autoinmunes.
- Síndrome de Down.
- Síndrome de Turner.
- Síndrome de Williams.
- Esterilidad.
- Historia de aborto espontáneo.
- Aumento inexplicable de aminotransferasas.
- Dermatitis herpetiforme.
Cuadro clínico
La enfermedad se manifiesta a través de un amplio espectro de signos y síntomas. Aproximadamente la mitad de los casos se presentan de forma atípica:
- La manifestación típica se asocia con malabsorción intestinal resultante del daño de la mucosa.
- Diarrea frecuente.
- Esteatorrea.
- Distensión abdominal.
- Flatulencia.
- Déficit somático.
- Pérdida de peso.
- Náuseas y vómitos.
Manifestaciones atípicas
- Enfermedad neuropsiquiátrica: Cefalea, neuropatía periférica, ataxia, depresión, distimia, ansiedad y epilepsia.
- Artritis.
- Deficiencia de hierro con o sin anemia.
- Cambios en el metabolismo óseo: Osteopenia/osteoporosis.
- Enfermedad renal: Depósito de IgA.
- Fatiga crónica.
- Dermatitis herpertiforme.
- Infertilidad, abortos espontáneos recurrentes.
- Hipertransaminasemia aislada.
- Estomatitis aftosa.
Crisis celíaca: Forma aguda grave de la enfermedad, precipitada por factores como embarazo, infección, cirugía:
- Manifestaciones clínicas: Diarrea intensa, deshidratación y trastornos metabólicos.
- Marcadores de gravedad: Enfermedad celíaca refractaria y neoplasias malignas (linfoma de células T).
La intolerancia secundaria a la lactosa es común.
Enfoque diagnóstico
Exámenes generales de laboratorio: Hemograma, AST, ALT, FA, GGT, albúmina, hierro, ferritina, IST, ácido fólico, vitamina B12, vitamina D, TSH, glicemia en ayunas, INR, sodio, potasio, magnesio, zinc, cobre sérico.
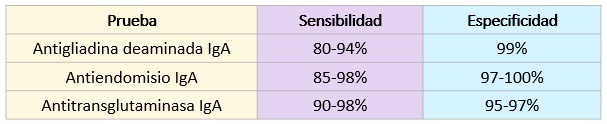
Serología: Ante la sospecha enfermedad celíaca, se deben realizar pruebas de autoanticuerpos como screening. Las principales pruebas serológicas para detectar la intolerancia al gluten son el anticuerpo antigliadina, antiendomisio y antitransglutaminasa IgA o IgG. Las pruebas basadas en IgG son útiles para detectar enfermedad celíaca en pacientes seleccionados con deficiencia de IgA, pero tienen menor sensibilidad y especificidad. La prueba de anticuerpos antiendomisio o antitransglutaminasa es superior a la de antigliadina, que ya no se recomienda. Se puede utilizar la nueva generación de la prueba, llamada antigliadina desaminada.
La deficiencia de inmunoglobulina A, presente en el 2-3% de los pacientes celíacos, es responsable de resultados falsos negativos en las pruebas serológicas para la clase IgA. Por este motivo, es necesario medir simultáneamente la inmunoglobulina A. La evaluación serológica debe realizarse con una dieta que contenga gluten, siendo la IgA antitransglutaminasa la prueba de primera elección.
Los pacientes con serología positiva y biopsia compatible con dermatitis herpetiforme no requieren biopsia duodenal para el diagnóstico.
En niños con alto riesgo de enfermedad celíaca (síndrome de Down, diabetes tipo 1, historia familiar en pariente de primer grado, tiroiditis autoinmune, síndrome de Turner, síndrome de Williams, deficiencia selectiva de IgA), asintomáticos, se inicia el screening con antitransglutaminasa IgA, a partir de los 3 años de edad. La serología se repite cada 3-5 años durante la infancia. Algunos autores inician el screening antes de los 2 años de edad.
Endoscopia gastrointestinal alta: Para el diagnóstico definitivo de enfermedad celíaca es imprescindible la realización de Endoscopia gastrointestinal alta con biopsia del intestino delgado (duodeno) visando la realización de un examen histopatológico, considerado el gold estándar para el diagnóstico. Está indicado para pacientes con serología positiva o pacientes con alta sospecha con serología negativa. La biopsia debe constar de al menos cuatro a seis fragmentos, incluida una muestra del bulbo y de las porciones más distales del duodeno, y debe realizarse incluso si el aspecto macroscópico es normal.
Histología: La lesión clásica de la enfermedad celíaca consiste en mucosa plana o casi plana, con criptas alargadas y aumento de mitosis, epitelio superficial cuboideo, con vacuolización, borde estriado borroso, aumento del número de linfocitos intraepiteliales y lámina propia con infiltrado denso de linfocitos y células plasmáticas. Debe clasificarse según los criterios establecidos por Marsh modificados por Oberhuber:
- Estadio 0 (patrón pre-infiltrativo), con un fragmento sin cambios histológicos (normal).
- Estadio I (patrón infiltrativo), en el que la arquitectura de la mucosa parece normal con un aumento del infiltrado de linfocitos intraepiteliales (LIE) > 40 por 100 enterocitos.
- Estadio II (lesión hiperplásica), caracterizado por hiperplasia de las criptas y aumento del número de LIE, sin atrofia.
- Estadio III (patrón destructivo) (considerado diagnóstico), en el que hay presencia de atrofia de las vellosidades, hiperplasia de las criptas y aumento del número de LIE. Subdividido en:
- 3a (atrofia parcial de las vellosidades).
- 3b (atrofia subtotal de las vellosidades).
- 3c (atrofia total de las vellosidades).
Los pacientes con autoanticuerpos positivos, IgA normal y biopsia de intestino delgado con resultados negativos en el examen histopatológico, se denominan pacientes celíacos potenciales. Se debe revisar el examen histopatológico y, si efectivamente es negativo, es decir, si la lesión clásica de la mucosa del intestino delgado está ausente, se debe considerar la posibilidad de una lesión en mosaico (patchy) y se debe indicar una nueva biopsia intestinal, obteniendo múltiples fragmentos.
Si, nuevamente, el patrón histológico no es de enfermedad celíaca, la existencia de esta enfermedad es poco probable. En presencia de infección por H. pylori, esta bacteria debe ser erradicada, ya que puede inducir atrofia de las vellosidades Marsh I.
Los pacientes con hallazgos histológicos compatibles con enfermedad celíaca, pero con serología negativa, deben someterse a pruebas HLA-DQ2 y DQ8. En presencia de haplotipos HLA-DQ2 o DQ8 se recomienda dieta libre de gluten durante 12-24 meses, con nueva endoscopia para evaluar la mucosa.
Los pacientes con una biopsia Marsh I o II no concluyente, con serología negativa, también deben someterse a pruebas de HLA-DQ2 y DQ8.
Pruebas genéticas: Deben utilizarse preferentemente para descartar el diagnóstico. Los pacientes que siguen una dieta sin gluten, pero con sospecha de enfermedad celíaca, deben someterse a pruebas de HLA-DQ2 y DQ8, después de la medición inicial de autoanticuerpos. Alrededor del 90-95% de los pacientes con enfermedad celíaca tienen la combinación de los alelos HLA-DQA1*0501 y HLA-DQB1*0201, en la configuración cis ó trans, que codifican el heterodímero DQ2. Los pacientes DQ2 negativos tienen HLA-DQA1*0301 y DQB1*0302, que codifican el heterodímero DQ8.
Si la pesquisa de HLA-DQ2 y DQ8 son positivos, se debe realizar un desafío con 3 g de gluten/día durante 2 semanas (al menos tres rebanadas de pan/día). Si el paciente lo tolera, ampliar la exposición al gluten hasta la 8ª semana y realizar EDA con biopsia duodenal y nueva medición de autoanticuerpos.
Densitometría ósea: Está indicada en el momento del diagnóstico. Posteriormente, cada 3 años si el primer examen es anormal, y cada 5 años si el primer examen es normal.
Clasificación
- Clásica o típica: Se caracteriza por la presencia de diarrea crónica, generalmente acompañada de distensión abdominal y pérdida de peso. También puede haber disminución del tejido celular subcutáneo, atrofia de la musculatura glútea, falta de apetito, alteracion del humor (irritabilidad o apatía), vómitos y anemia.
- No clásico o atípica: Se caracteriza por un cuadro mono u oligosintomático, en el que las manifestaciones digestivas están ausentes o, cuando están presentes, ocupan un segundo plano. Los pacientes pueden presentar manifestaciones aisladas, como talla estatura, anemia ferropénica refractaria a la reposición de hierro por via oral, anemia por deficiencia de folato y vitamina B12, osteoporosis, hipoplasia del esmalte dental, artralgias o artritis, constipación intestinal refractaria al tratamiento, retraso puberal, irregularidad del ciclo menstrual, esterilidad, abortos espontáneos recurrentes, ataxia, epilepsia (aislada o asociada a calcificación cerebral), neuropatía periférica, miopatía, manifestaciones psiquiátricas (depresión, autismo, esquizofrenia), úlcera aftosa recurrente, enzimas hepáticas elevadas sin causa aparente, debilidad, pérdida de peso sin aparente causa, edema de aparición abrupta después de una infección ó cirugía y dispepsia no ulcerosa.
- Asintomática o silenciosa: Se caracteriza por alteraciones serológicas e histológicas en la mucosa del intestino delgado compatibles con enfermedad celíaca, en ausencia de manifestaciones clínicas.
Indicaciones de testeo
Indicación de endoscopia con biopsia duodenal, incluso si la serología es negativa:
- Diarrea crónica no sanguinolenta inexplicable.
- Diarrea con características de malabsorción, especialmente pérdida de peso.
- Anemia por deficiencia de hierro en ausencia de otras causas.
- Síntomas gastrointestinales en pacientes con antecedentes familiares de enfermedad celíaca.
- Síntomas gastrointestinales en pacientes con enfermedades autoinmunes o deficiencia de IgA.
- Retraso en el crecimiento en niños.
- Dermatitis herpetiforme confirmada por biopsia.
- Presencia de atrofia vellositaria en la cápsula endoscópica.
- Gran volumen de pérdidas inexplicables por ileocolostomía.
Indicación de screening serológico (biopsia duodenal sólo si la serología es positiva):
- Síndrome del intestino irritable.
- Aumento inexplicable de las transaminasas.
- Síntomas gastrointestinales crónicos sin antecedentes familiares de enfermedad celíaca.
- Síntomas gastrointestinales crónicos sin enfermedad autoinmune asociada.
- Colitis microscópica.
- Tiroiditis de Hashimoto.
- La enfermedad de Graves.
- Osteopenia y osteoporosis temprana.
- Neuropatía periférica o ataxia inexplicable.
- Estomatitis aftosa recurrente.
- Alteraciones en el esmalte dental.
- Infertilidad, abortos espontáneos recurrentes, menarquia tardía, menopausia precoz.
- Síndrome de fatiga crónica.
- Epilepsia.
- Pancreatitis aguda o crónica sin etiología definida.
- Epilepsia.
- Migraña.
- Déficit de atención.
- Hiposplenismo o asplenia funcional.
- Psoriasis.
- Síndrome de Down y Turner.
- Hemosiderosis pulmonar: Síndrome de Lane-Hamilton.
- Nefropatía por IgA.
Diagnóstico diferencial
- Dispepsia funcional.
- Enteropatía asociada al VIH/SIDA.
- Inmunodeficiencia combinada.
- Sobrecrecimiento bacteriano en el intestino delgado.
- Enteropatía por radiación o quimioterapia.
- Enfermedad de injerto vs huésped.
- Enfermedad intestinal isquémica.
- Parásitos, especialmente giardiasis y estrongiloidiasis.
- Enfermedad de Crohn.
- Gastroenteritis eosinofílica.
- Síndrome de Zollinger-Ellison.
- Linfoma intestinal.
- Enfermedad de Whipple.
- Síndrome del intestino irritable.
- Intolerancia primaria a la lactosa.
- Insuficiencia pancreática exocrina.
- Colitis colagenosa.
Seguimiento
La velocidad de respuesta a una dieta sin gluten varía. En general, la mejoría clínica se nota en 2 semanas. Los síntomas mejoran más rápidamente que la histología.
Se sugiere una reevaluación a las 4-6 semanas de iniciada la dieta.
Seguimiento periódico de síntomas residuales o nuevos, evaluados por la adherencia a la dieta sin gluten, tanto por anamnesis como por pruebas serológicas y complicaciones.
Se deben utilizar anticuerpos antitransglutaminasa IgA, antiendomisio IgA o antigliadina desaminada IgA (o IgG) para controlar la respuesta y el cumplimiento de la dieta sin gluten. Se recomienda repetir la serología a los 6 y 12 meses después de la exclusión del gluten y posteriormente anualmente. Es preferible que los anticuerpos se midan siempre en el mismo laboratorio, dada la variación.
La exclusión del gluten de la dieta da como resultado una disminución gradual de los niveles de autoanticuerpos séricos. Normalmente se alcanza un valor inicial normal en un plazo de 3 a 12 meses, dependiendo de las concentraciones previas al tratamiento. La normalización de los anticuerpos no se correlaciona de manera confiable con la recuperación de la atrofia de las vellosidades.
Si no hay mejoría clínica y/o disminución de la serología, se debe evaluar la transgresión dietética, enfermedad celíaca refractaria y diagnósticos diferenciales.
Complicaciones
- Mayor riesgo de neoplasias (adenocarcinoma de intestino delgado, neoplasia de esófago, linfoma no Hodgkin B y T, neoplasias orofaríngeas).
- Ataxia celíaca.
- Linfoma intestinal de células T.
- Infertilidad inexplicable (12%).
- Osteoporosis (30-40%) y fracturas.
- Deficiencias de macro y micronutrientes.
- Desnutrición severa.
Enfoque terapéutico
Como regla general, existen seis elementos claves en el manejo de los pacientes con enfermedad celíaca:
- Consulta con un nutricionista calificado.
- Educación sobre la enfermedad.
- Adherencia a una dieta sin gluten a lo largo de la vida.
- Identificación y tratamiento de deficiencias nutricionales.
- Acceso a grupo de defensa.
- Seguimiento continuo a largo plazo por parte de un equipo multidisciplinario.
El único tratamiento disponible hasta la fecha para la enfermedad celíaca es una dieta estricta sin gluten. Esta exclusión debe ser definitiva. En la mayoría de los pacientes, la ausencia de gluten es suficiente para mejorar los síntomas y prevenir las complicaciones de la enfermedad celiaca.
Puede ser necesario excluir inicialmente la lactosa, debido a una intolerancia temporal a este carbohidrato hasta que se restablezca la mucosa intestinal.
Se debe advertir a los pacientes que presten atención a las etiquetas y envases de los alimentos.
Existen dos tipos de transgresiones en relacion al gluten:
- Transgresión voluntaria: El paciente con enfermedad celíaca sabe que consume gluten y lo hace de forma voluntaria.
- Transgresión involuntaria: El paciente con enfermedad celíaca ingiere gluten sin saberlo: Algún alimento que no contiene gluten, pero que, durante su elaboración, puede haber entrado en contacto con otros ingredientes que contienen esta proteína (contaminación cruzada).
Están permitidos los siguientes alimentos que pueden utilizarse en la preparación de recetas sin gluten: Crema de arroz o maíz, harina de arroz, maíz, yuca o plátano; hojuelas de arroz, maíz y quinoa (ó quinua); almidón de patata o yuca, almidones de yuca agrios o dulces; harina de maíz molida; almidón de maíz o arroz, yuca, maíz molido, arroz, frijol, maíz, soja, garbanzos, guisantes, fideos de arroz, soja o frijoles, frutos secos (ciruelas pasas, pasas, albaricoques, plátanos, etc), castañas, nueces, maní, semillas de lino, calabaza, amapola, girasol, sésamo, frutas en general, patatas, zanahorias, remolachas; carne de res, cerdo, pollo, pescado, así como huevos y mariscos.
Controle los niveles de vitamina B12, hierro, ácido fólico y vitamina D.
Vacunar contra el neumococo. La enfermedad celiaca cursa con hipoesplenismo.
Un estudio reciente no observó aumento del riesgo de muerte en pacientes con enfermedad celiaca infectados por Covid-19.
Recientemente, Schuppan et al. evaluaron el fármaco ZED1227, capaz de inhibir la transglutaminasa 2 con alta especificidad, previniendo la formación de gluten desaminado y, por tanto, la inducción y activación de células T específicas del gluten. El fármaco ZED1227 pudo atenuar el daño inducido por el gluten en la mucosa duodenal en pacientes con enfermedad celiaca expuestos a cantidades moderadas de gluten y serán evaluados en la fase 3.
Enfermedad celíaca refractaria
El diagnóstico de enfermedad celiaca refractaria se realiza ante la presencia de síntomas persistentes o recurrentes, asociados a signos de malabsorción intestinal y atrofia de las vellosidades, a pesar de una dieta sin gluten durante más de 12 meses, excluyendo otros diagnósticos. Se puede clasificar en:
- Tipo I: Forma con mejor pronóstico; linfocitos intraepiteliales dentro de lo esperado para la enfermedad celiaca, con expresión normal de CD3/CD8.
- Tipo II: Forma más grave de la enfermedad, con alta mortalidad. En la inmunohistoquímica se observan linfocitos intraepiteliales CD3 positivos con baja expresión de CD8. Está indicada la terapia inmunosupresora con prednisona o budesonida + azatioprina (2-2.5 mg/kg/día). En pacientes críticos, se puede utilizar cladribina 0.15 mg/kg/día durante 5 días. Puede ser necesaria una nutrición parenteral total para recuperar el estado nutricional.
(Ver – Sindrome de intestino irritable)
Referencias bibliográficas
Husby S, Koletzko S, Korponay-Szabó I, et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition guidelines for diagnosing coeliac disease 2020. J Ped Gastroenty Nutr. 2020; 70(1): 141-156.
Schuppan D, Mäki M, Lundin KAE, et al. A randomized trial of a transglutaminase 2 inhibitor for celiac disease. N Engl J Med. 2021; 385(1):35-45.
Pinto-Sanchez MI, Silvester JA, Lebwohl B, et al. Society for the Study of Celiac Disease position statement on gaps and opportunities in coeliac disease Nat Rev Gastroenterol Hepatol. 2021; 1-10.
Uche-Anya E, Husby S, Kaplan GG, et al. An international reporting registry of patients with celiac disease and COVID-19: initial results from SECURE-CELIAC. Clin Gastroenterol Hepatol. 2021; 19(11):2435-2437.e4.
Celdir MG, Jansson-Knodell CL, Hujoel IA, et al. Latitude and celiac disease prevalence: a meta-analysis and meta-regression. Clin Gastroenterol Hepatol. 2022; 20(6):e1231-e1239.
Catassi C, Verdu EF, Bai JC, et al. Coeliac disease. Lancet. 2022; 399(10344):2413-2426.
Bai JC, Frieid M, Corazza, et al. Doença celíaca. World Gastroenterology Organisation Global Guidelines, 2012.
Rubio-Tapia A, Hill ID, Kelly CP, et al. ACG Clinical Guidelines: diagnosis and management of celiac disease. Am J Gastroenterol. 2013; 108(5):656-676.
Ludvigsson JF, Bai JC, Biagi F, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut. 2014; 63(8):1210-1228.
Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019; 7(5):583-613.
Husby S, Murray JA, Katzka DA, et al. AGA Clinical Practice Update on diagnosis and monitoring of Celiac disease — changing utility of serology and histologic measures: expert review. Gastroenterol. 2019; 156(4):885-889.
Sugerencias y comentarios al correo: contacto@galenbook.com

