Actualizado 12 mayo 2024
Definición
Condición abdominal aguda resultante de una agresión inflamatoria al tejido pancreático causada por la autodigestión, con afectación variable de los tejidos peripancreáticos y posibles repercusiones sistémicas.
Fisiopatología
La agresión inflamatoria conduce a la colocalización de gránulos de zimógeno, que contienen tripsinógeno, con lisosomas repletos de catepsina B.
Ocurre una transformación de tripsinógeno en tripsina y liberación de catepsina B en el citosol.
Luego comienza una cascada inflamatoria que culmina en necrosis y apoptosis celular.
Etiología
- Biliar (40-50%).
- Alcohólica (10-40%).
- Hipertrigliceridemia (1-4% de las condiciones agudas).
- Hipercalcemia (hiperparatiroidismo primario).
- Post-colangiopancreatografía retrógrada endoscópica – CPRE (3-25% de los casos).
- Medicamentosa (antirretrovirales, sulfa, azatioprina, 6-mercaptopurina, tetraciclina, aminosalicilatos, diuréticos, estrógenos y hormonas esteroides, metildopa, codeína, enalapril, furosemida, simvastatina, ácido valproico, metronidazol, mesalazina, losartan, amiodarona, omeprazol, isoniazida, dexametasona, clomifeno, etc).
- Post-infecciosa:
- Viral (paperas, coxsackie, hepatitis A, hepatitis B, hepatitis E, CMV, varicela-zoster, herpes simple, VIH).
- Bacteriana (Mycoplasma, Legionella, Leptospira, Salmonella).
- Hongos (Aspergillus).
- Parasitario (Toxoplasma, Cryptosporidium, Ascaris).
- Asociado a enfermedades vasculares:
- Vasculitis (principalmente lupus eritematoso sistémicoy poliarteritis nudosa).
- Ateroembolismo, hipotensión intraoperatoria, shock hemorrágico, isquemia.
- Asociado a malformaciones congénitas: Páncreas divisum.
- Mutaciones genéticas: CEL, CPAI, CASR, CFTR, CTRC, PRSS1 y SPINK1.
- Trauma.
- Disfunción del esfínter de Oddi.
- Quiste de colédoco, coledococele.
- Estenosis post-necrótica del conducto pancreático.
- Post-biopsia pancreática.
- Pólipo de la vesícula biliar.
- Autoinmune.
- Accidente escorpiónico.
- Neoplasias (tumores periampulares, IPMN).
- Idiopática (10-25% de los casos).
Presentación clínica
Epidemiología
- Incidencia de 5-35 casos por 100.000 personas.
- Mortalidad promedio del 3-17%.
- La forma leve del cuadro es la más común.
- La forma grave es menos frecuente (10-20%), independientemente de la causa, y puede alcanzar un 25-45% de la morbimortalidad.
- Alrededor del 21% presentan episodios recurrentes de pancreatitis y, de ellos, el 8% desarrolla pancreatitis crónica.
- El tabaquismo es un factor de riesgo independiente para pancreatitis aguda y crónica.
- La colelitiasis y el alcoholismo constituyen el 80% de las etiologías de la pancreatitis aguda.
Cuadro clínico
- Dolor abdominal:
- Continuo en la parte superior del abdomen, en forma de barra con irradiación hacia la espalda.
- Alivio al asumir la posición genupectoral (“posición de oración mahometana”).
- La característica evolutiva del dolor puede sugerir la etiología subyacente de la pancreatitis.
- Pancreatitis biliar: Dolor bien localizado de aparición repentina, que alcanza su máxima intensidad en 10-20 minutos.
- Pancreatitis alcohólica/metabólica: Dolor sordo, mal localizado, de aparición gradual.
- Náuseas y vómitos.
- Signos de gravedad: Síndrome de respuesta inflamatoria sistémica (SRIS):
- Fiebre alta (≥ 38.5 °C).
- Taquicardia e hipotensión, que pueden progresar a un shock hipovolémico más distributivo. Hasta un 5-10% de los pacientes con pancreatitis aguda grave pueden presentar sólo hipotensión y síndrome de respuesta inflamatoria sistémica, sin el dolor típico.
- Taquipnea que puede progresar a síndrome de dificultad respiratoria aguda.
- Disminución del nivel de conciencia.
Factores de riesgo
- Antecedentes de litiasis biliar.
- Antecedentes de alcoholismo crónico.
- Hipercalcemia.
- Hipertrigliceridemia (triglicéridos séricos > 1000 mg/dL).
- Uso de medicamentos pancreatotóxicos.
- Traumatismo abdominal.
- Hipovolemia.
- Procedimiento intervencionista reciente en el árbol biliar (principalmente CPRE).
- Libación alcohólica.
Examen físico
- Dolor a la palpación abdominal.
- Ictericia (hallazgo inusual que sugiere coledocolitiasis o edema de la cabeza pancreática).
- Taquicardia.
- Taquipnea.
- Hipotensión.
- Fiebre.
- Disminución del nivel de conciencia.
- Reducción o ausencia de los ruidos respiratorios en la base izquierda debido al derrame pleural.
- Pueden presentarse signos de irritación peritoneal.
- Distensión abdominal con peristaltismo débil por íleo paralítico secundario al proceso inflamatorio intraabdominal.
- Retinopatía de Purtscher (pérdida súbita de la visión, rara complicación de la pancreatitis).
- Signo de Grey-Turner: Equimosis en flancos.
- Signo de Cullen: Equimosis periumbilical.
- Signo de Fox: Equimosis en la base del pene.
- Necrosis de la grasa subcutánea (paniculitis).
- Xantomas y xantelasmas (sugieren etiología hiperlipidémica).
- Aumento de tamaño de las parótidas (sugiere etiología alcohólica).
Enfoque diagnóstico
Consideraciones iniciales
El diagnóstico de pancreatitis aguda requiere la presencia de dos de tres criterios diagnósticos:
- Cuadro clínico sugestivo: Dolor en la región epigástrica o en la parte superior del abdomen, en forma de banda o barra, persistente, irradiado hacia la espalda.
- Amilasa y/o lipasa superior a tres veces el límite superior normal.
- Examen de imagen sugestivo de pancreatitis aguda (tomografía computarizada, resonancia magnética).
Exámenes de laboratorio
- Hemograma completo:
- Puede presentarse leucocitosis con desviación hacia la izquierda (hasta 20.000 leucocitos/mm3) y aumento de la hemoglobina y el hematocrito (hemoconcentración).
- Electrolitos (incluido calcio):
- Los trastornos hidroelectrolíticos son muy comunes en la pancreatitis, principalmente por vómitos repetidos y pérdida de volumen al tercer espacio, así como consumo de calcio por el propio proceso fisiopatológico.
- Los cambios más comunes son: Hiponatremia, hipocalemia e hipocalcemia.
- Urea y creatinina:
- Comúnmente alterado en presencia de shock y casos de secuestro severo de líquido en el tercer espacio, configurando lesión renal aguda prerrenal, que puede progresar a necrosis tubular aguda, si el reemplazo de volumen es insuficiente para restaurar la perfusión renal.
- Urea: Por cada aumento de 10.8 mg/dL durante las primeras 24 horas, la mortalidad es 2.2 veces mayor.
- Creatinina: Elevada dentro de las primeras 48 horas y puede predecir el desarrollo de necrosis pancreática.
- Glicemia.
- Amilasa y lipasa:
- La elevación de amilasa y/o lipasa superior a tres veces el límite superior es un criterio diagnóstico de pancreatitis.
- Lipasa > 450 y amilasa > 500 son umbrales que presentan mayor especificidad diagnóstica para pancreatitis aguda.
- Amilasa sérica: Se eleva entre 6 y 12 horas después del inicio del cuadro y permanece positiva durante 3 a 5 días. Por lo tanto, no es un buen marcador para los pacientes que acuden tarde a la atención de urgencias. En el 20% de los casos de pancreatitis alcohólica y en el 50% de los de hipertrigliceridemia puede no existir este aumento. Sensibilidad = 67-83%, especificidad 85-98%.
- Lipasa sérica: Se eleva entre 4 y 8 horas después del inicio del cuadro y permanece positiva durante 8 a 14 días. Sensibilidad 79-100%, especificidad 82-100%.
- Las enzimas pancreáticas no son marcadores de pronóstico ni de gravedad.
- Perfil hepático:
- Los cambios sugestivos de pancreatitis biliar incluyen aumento de transaminasas, enzimas canaliculares e hiperbilirrubinemia con predominio de la directa, que caracteriza la colestasis por litiasis biliar o microlitiasis biliar.
- TGP (ALT) > 150 es un umbral que presenta mayor especificidad para pancreatitis biliar (< 150, sin embargo, no descarta el diagnóstico).
- Proteína C-reactiva: Si > 150 mg/dL, sugiere pancreatitis aguda grave.
- Deshidrogenasa láctica (LDH).
- Lactato.
- Gasometría arterial: Los cuadros más leves, en presencia de vómitos, cursan con alcalosis metabólica. Los cuadros más graves con disfunción renal y síndrome de respuesta inflamatoria sistémica se presentan con acidosis metabólica.
- Proteínas totales y albúmina sérica.
- En ausencia de una etiología evidente, también se solicitan triglicéridos e IgG4.
Exámenes de imagen
No están indicados de forma rutinaria. Se reserva para casos dudosos, en los que los criterios diagnósticos no están concretos, o en presencia de algún signo de gravedad, en los que el examen de imagen es importante en la evaluacion pronóstica y en la adopción de medidas terapéuticas.
- Radiografía simple de abdomen y tórax:
- Pueden estar indicadas para excluir otras causas de abdomen agudo, aunque no presentan ninguna alteracion específica para pancreatitis.
- Hallazgos: Distensión de asas, asa centinela (delgada) o signo de cut-off (colon distal); elevación del hemisferio diafragmático, derrame pleural, atelectasia basal, infiltrado pulmonar o síndrome de dificultad respiratoria aguda.
- Ultrasonido abdominal:
- Examen importante para el diagnóstico diferencial así como para la definición etiológica de afecciones biliares. Debe realizarse al ingreso.
- Puede utilizarse como alternativa en el diagnóstico y puede revelar un aumento difuso del páncreas y la presencia de cálculos biliares en la vesícula y en el ducto biliar común.
- A menudo, la distensión de asas intestinales dificulta la visualización y limita la calidad del examen.
- El líquido peripancreático puede revelarse como una colección anecoica.
- Tomografía computarizada abdominal con contraste:
- Puede demostrar un aumento focal o difuso del páncreas con edema intersticial significativo (pancreatitis edematosa).
- La falta de captación de contraste indica áreas de necrosis pancreática (pancreatitis necrotizante).
- Los cálculos biliares pueden eventualmente detectarse mediante TC.
- A partir del tercer o cuarto día de la enfermedad, la TC abdominal con contraste puede establecer la presencia y extensión de la necrosis pancreática y complicaciones locales y predecir la gravedad del cuadro.
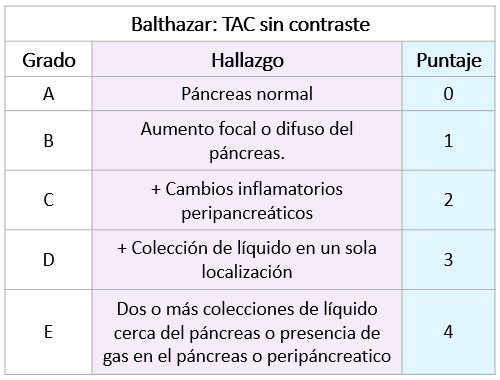
- Esencial para definir el escore pronóstico tomográfico de Balthazar (Acute Pancreatitis Severity Index, 1990), indicando un cuadro grave si suma ≥ 6.
- Fuerte asociación entre necrosis > 30% y morbimortalidad > 5: Mortalidad 8 veces mayor, 17 veces mayor probabilidad de hospitalización prolongada, 10 veces mayor riesgo de ser sometido a necrectomia.

- Resonancia magnética de abdomen con colangiopancreatorresonancia:
- Examen más sensible para el diagnóstico precoz de pancreatitis y la detección de necrosis pancreática y complicaciones.
- Para el diagnóstico de coledocolitiasis, es comparable a la colangiopancreatografía retrógrada endoscópica (CPRE).
- Alternativa a la tomografía computarizada en pacientes que no deben estar expuestos a radiación (ej. mujeres embarazadas) y para la evaluación de la necrosis pancreática en pacientes con insuficiencia renal (con contraindicación para el uso de contraste en TC).
Escores pronósticos
Se pueden aplicar varios escores pronósticos para evaluar la gravedad del cuadro, entre los que destacan los criterios Revisados de Atlanta, el escore de Ranson, el SAPS II y el escore de Balthazar.
Escore de Ranson
Consta de 11 criterios clínico-laboratoriales, cinco de los cuales se evalúan al ingreso y seis dentro de las 48 horas posteriores al ingreso, que determinan el pronóstico.
Existe variación en los valores según la etiología (no biliar o biliar).
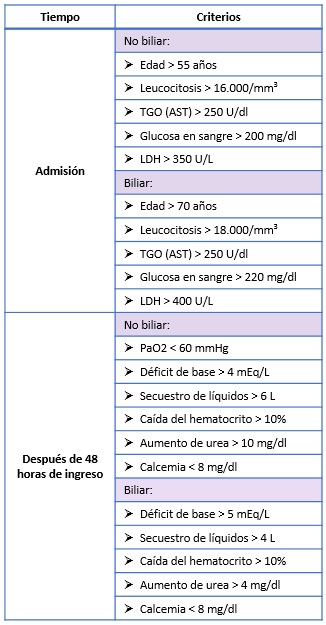
Interpretación:
- Ranson < 3: Pancreatitis leve (0-3% de mortalidad).
- Ranson ≥ 3: Pancreatitis grave (11-15% de mortalidad).
- Ranson ≥ 6: Pancreatitis muy grave (40% de mortalidad).
Atlanta revisado
- Pancreatitis aguda leve.
- Pancreatitis aguda moderada.
- Pancreatitis aguda grave.
Criterios recomendados por las principales guías internacionales. Utiliza el escore de Marshall modificada para definir la disfunción orgánica.
Índice de gravedad tomográfica (CTSI)
Variación del escore de Balthazar, creada por el mismo autor.
Inflamación pancreática:
- 0 puntos: Páncreas normal.
- 1 punto: Irregularidades focales o difusas.
- 2 puntos: Inflamación peripancreática con anomalías intrínsecas.
- 3 puntos: Colecciones intra y/o extrapancreáticas.
- 4 puntos: Dos o más colecciones (con presencia de gas) en páncreas o retroperitoneo.
Necrosis pancreática (en%):
- 0 puntos: Ausente.
- 2 puntos: < 30%.
- 4 puntos: > 30% – < 50%.
- 6 puntos: > 50%.
Clasificación:
- 0-3: Pancreatitis aguda leve.
- 4-6: Pancreatitis aguda moderada.
- 7-10: Pancreatitis aguda grave.
Marcadores clínico-laboratoriales de peor pronóstico
- PCR > 150 mg/dL en 48 horas.
- APACHE II ≥ 8.
- Escore de Ranson ≥ 3.
- Edad > 75 años.
- Obesidad.
- Falla orgánica > 48 horas.
- Signos de hemoconcentración: Aumento de la urea y hematocrito (> 44%).
Definiciones de Atlanta revisadas
En cuanto a la gravedad:
- Leve: Sin falla orgánica ni complicaciones locales o sistémicas.
- Moderado: Falla orgánica que se resuelve en 48 horas y/o complicaciones locales o sistémicas.
- Grave: Falla orgánica sostenida durante más de 48 horas.
La definición de falla orgánica se basa en el escore de Marshall Modificado (2 o más puntos).
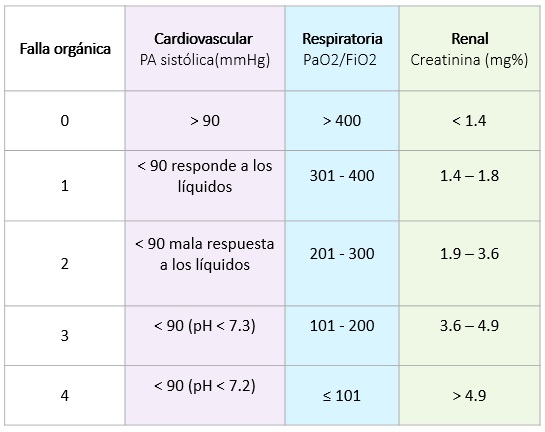
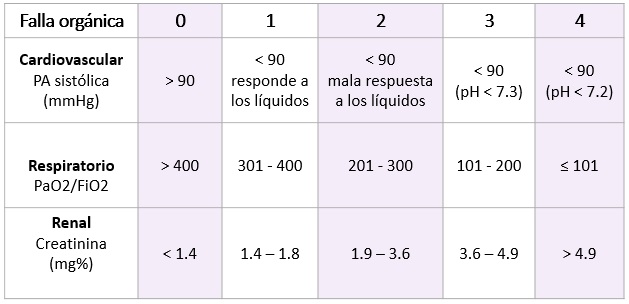
En cuanto a la presentación:
- Pancreatitis intersticial edematosa:
- Comprende el 85% de los casos.
- Caracterizada por aumento focal o difuso del páncreas sin presencia de necrosis.
- Generalmente de forma más leve, con resolución en la mayoría de los casos dentro de la primera semana.
- Pancreatitis necrotizante:
- Comprende el 15% de los casos.
- Es la forma de peor pronóstico.
- Caracterizada por inflamación con la consiguiente necrosis del tejido pancreático o peripancreatico.
En cuanto a las fases de la enfermedad:
- Fase inicial:
- Cursa con síndrome de respuesta inflamatoria sistémica intensa.
- La falla orgánica es el principal determinante de la gravedad.
- Suele finalizar en la primera semana, aunque puede durar hasta el final de la segunda semana.
- Fase tardía:
- Caracterizada por la persistencia de signos inflamatorios o la aparición de complicaciones locales.
- Sólo ocurre en pancreatitis de moderada a grave.
- La falla orgánica sigue siendo el principal determinante de la gravedad.
En cuanto a las complicaciones:
- Colecciones peripancreáticas agudas (< 4 semanas).
- Colecciones necróticas agudas (< 4 semanas).
- Pseudoquiste (> 4 semanas).
- Necrosis pancreática aislada – walled-off (> 4 semanas).
- Necrosis infectada.
- Trombosis venosa portoesplenomesentérica.
Diagnóstico diferencial
- Enfermedad úlcero-péptica o dispepsia.
- Colangitis.
- Coledocolitiasis.
- Colecistitis aguda.
- Apendicitis aguda.
- Obstrucción intestinal.
- Perforación de víscera hueca.
- Enfermedad renal derecha (principalmente nefrolitiasisy pielonefritis).
- Hepatitis aguda.
- Isquemia mesentérica aguda.
- Cetoacidosis diabética.
- Macroamilasemia.
- Enfermedades de las glándulas salivales.
- Síndrome de Gullo.
- Síndrome coronario agudo.
Enfoque terapéutico
Conducta general
Todos los pacientes deben ser hospitalizados para analgesia, hidratación y seguimiento, así como para evaluación de terapia antibiótica y propuesta de debridamiento quirúrgico.
Los pacientes que cumplan los criterios de gravedad o con escore pronóstico indicativo de pancreatitis grave deben ser monitorizados en cuidados intensivos.
En general, el tratamiento se basa en el soporte clínico.
No está indicado el uso rutinario de profilaxis para hemorragia gastrointestinal.
Hidratación
- Hidratación endovenosa a una velocidad de 5 a 10 ml/kg/hora con cristaloides (solución salina isotónica o solución de Ringer lactato, primera opción) para todos los pacientes, excepto los pacientes con enfermedades cardíacas y enfermedades renales crónicas, para quienes la velocidad de infusión debe individualizarse.
- En pacientes con hipotensión y taquicardia, una dosis rápida de 20 ml/kg durante 30 minutos, seguida de 3 ml/kg/hora durante 8 a 12 horas.
- Objetivos:
- FC < 120 lpm.
- PAM de 65-85 mmHg.
- Diuresis > 0.5-1.0 ml/kg/hora.
- Reducción de la hemoconcentración (hematocrito del 35-44%).
- Descenso de la urea en las primeras 24 horas.
- Se debe limitar la reposición de líquidos principalmente a las primeras 24 a 48 horas.
Recientemente se publicó el ensayo clínico aleatorizado Waterfall, que propone un nuevo modelo de abordaje para pacientes con pancreatitis aguda a través de una hidratación moderada. En este estudio, la reanimación temprana e intensiva con líquidos dio lugar a una mayor incidencia de sobrecarga de líquidos (20.5 % frente al 6.3 %) sin mejorar los resultados clínicos.
- Inicialmente se debe evaluar la volemia del paciente:
- Si paciente hipovolémico: Lactato de Ringer 10 mL/kg en las primeras 2 horas, seguido de 1.5 mL/kg/hora durante 12 horas.
- Si paciente normovolémico: Lactato de Ringer 1.5 mL/kg/hora durante 12 horas.
- Reevaluar la volemia del paciente a las 12, 24, 48 y 72 horas. Permitir dieta oral si la intensidad del dolor es < 5/10 y el paciente tiene ganas de comer. A las reevaluaciones:
- Si paciente hipovolémico: Lactato de Ringer 10 ml/kg durante 2 horas, seguido de 1.5 ml/kg/hora. Se pueden administrar bolos adicionales de 10 ml/kg si el debito urinario es inferior a 0.5 ml/kg/hora o la presión arterial sistólica es < 90 mmHg.
- Si paciente normovolémico: Lactato de Ringer1.5 ml/kg/hora. Se debe suspender la hidratación endovenosa tan pronto el paciente tolere la dieta durante más de 8 horas (Por lo menos 20 horas de hidratación endovenosa).
- Si paciente hipervolémico: Reducir o suspender la hidratación y tratar la hipervolemia.
Analgesia
- Es fundamental tratar el dolor según su intensidad, utilizando desde analgésicos no narcóticos hasta derivados opioides, como recomienda la OMS.
- La vía de administración preferida es la endovenosa.
- Opioides:
- También se puede utilizar morfina (no hay estudios que demuestren que pueda agravar o causar pancreatitis por aumento de presión en el esfínter de Oddi).
- La meperidina se utiliza clásicamente bajo la teoría que no interfiere en el esfínter de Oddi; sin embargo, tiene un alto grado de adición. Se debe prestar atención a la acumulación del metabolito normeperidina, que se relaciona con efectos secundarios neuromusculares y, raramente, convulsiones.
- El fentanilo tiene el mejor perfil de seguridad.
Corrección de trastornos hidroelectrolíticos
- La hipocalcemia debe corregirse si el calcio ionizado es bajo o hay signos de irritabilidad neuromuscular (signos de Chvostek o Trousseau).
- La reducción de magnesio también puede causar hipocalcemia y debe corregirse.
Nutrición
- En casos leves, se puede mantener la dieta oral si hay un control adecuado del dolor, independientemente de los niveles de lipasa/amilasa.
- Si la ingesta oral es imposible, se debe dar preferencia a la nutrición enteral antes que a la parenteral y debe iniciarse precozmente (24-72 horas después del ingreso) si se tolera. Permite el mantenimiento del trofismo intestinal, reducción de la disbiosis y mantenimiento de una adecuada actividad inmunológica, con menor riesgo de translocación bacteriana y perpetuación de la respuesta inflamatoria sistémica.
- La presencia de colecciones líquidas o enzimas pancreáticas elevadas no es necesariamente una contraindicación para iniciar una dieta oral o enteral.
- No existen diferencias en el resultado entre la vía nasogástrica y nasoyeyunal, siendo la primera la vía preferida y la segunda reservada para la intolerancia digestiva.
- El soporte nutricional está indicado en condiciones graves y debe instaurarse precozmente:
- Los pacientes con pancreatitis aguda deben ser considerados de moderado a alto riesgo nutricional. Cuando el cuadro es de leve a moderado debe ser sometido a exámenes nutricionales y definirse como de alto riesgo cuando las condiciones son graves.
- Dar preferencia a la dieta enteral (no se requiere catéter nasoenteral post-pilórico, a pesar de que algunos lo indican).
- Sólo debe iniciarse después de una reanimación volémica adecuada.
- No hay necesidad de fórmulas semi-elementales.
- En pacientes con presión intraabdominal < 15 mmHg; aquellos sometidos a necrectomia mínimamente invasiva (después de la estabilización dentro de las 24 horas posteriores al procedimiento) o peritoneostomía (incluso con una dieta de bajo volumen) no existen contraindicaciones absolutas para la vía de alimentación enteral.
- En casos de aumento de la presión intraabdominal > 20 mmHg se debe suspender la dieta enteral.
- Dieta parenteral: Preferiblemente no exclusiva sino complementaria, si el paciente:
- No tolera la vía enteral ya sea por dolor o empeoramiento de los marcadores inflamatorios.
- Incapacidad para lograr el objetivo nutricional con terapia enteral exclusiva dentro de las 48 a 72 horas.
- Contraindicaciones para la vía enteral.
- Íleo significativo o vómitos a repetición.
- Colecciones con efecto de masa que impiden el tránsito gastrointestinal adecuadamente.
- Presencia de absceso pancreático o fístula pancreática.
- Síndrome de hipertensión intraabdominal o presión intraabdominal > 20 mmHg.
- Aspectos de la terapia nutricional:
- Aporte energético cuantificado mediante calorimetría indirecta (gold standard), ecuación de Harris-Benedict o fórmula de bolsillo (25-30 kcal/kg/día), con un 50% representado por carbohidratos.
- Contenido proteico de 1.5-2 g/kg/día (hiperproteico).
- Aporte de lípidos < 30-35% del total de calorías (0.8-1.5 g/kg/día). Puede excluirse en caso de hipertrigliceridemia (> 500 mg/dL).
- La mayoría de los pacientes toleran una dieta polimérica.
- Monitoreo obligatorio de electrolitos, glucosa en sangre y triglicéridos.
- La L-glutamina (0.2 g/kg/día) está indicada como complemento de la dieta parenteral para inmunomodulación en casos seleccionados en los que existe contraindicación/intolerancia a la dieta enteral.
- Los probióticos no están indicados en condiciones graves.
- La suplementación con enzimas pancreáticas no está indicada, excepto en casos de clara insuficiencia pancreática exocrina.
Antibioticoterapia
- Hasta el 20% de los pacientes con pancreatitis aguda pueden desarrollar una infección extrapancreática, que se asocia con una mayor mortalidad.
- El uso de antibióticos profilácticos no está indicado, independientemente del tipo, extensión de la necrosis o gravedad de la pancreatitis.
- Indicación – sospecha de infección:
- Necrosis pancreática o extrapancreática que evoluciona con deterioro del estado general y/o criterios infecciosos de laboratorio.
- Ausencia de mejoría clínica después de 7 a 10 días de estancia hospitalaria.
- Procalcitonina > 1.0 nanogramos/mL.
- Tomografía abdominal con presencia de gas en zona necrótica.
- La antibioticoterapia debe iniciarse rápidamente con un esquema empírico inicial:
- La mayoría de las infecciones son monomicrobianas (generalmente E. coli, Enterobacter cloacae, Enterococcus faecalis, Bacteroides fragilis, Klebsiella).
- Se debe realizar durante 3-4 semanas, ajustando según la respuesta clínica-laboratorial.
- Esquemas antimicrobianos empíricos. Se debe elegir uno de estos esquemas:
- Ciprofloxacino 400 mg EV cada 12 horas + Metronidazol 500 mg EV cada 8 horas.
- Cefepima1-2 g EV cada 8 horas + Metronidazol 500 mg EV cada 8 horas.
- Piperacilina tazobactam 4.5 g EV cada 6 horas.
- En algunos casos se puede utilizar la punción con aguja fina guiada por tomografía para recolectar material para cultivo, permitiendo así ajustar la terapia antibiótica.
- Los pacientes que no responden a la terapia con antibióticos incluso asi esta sea guiada o que progresan a una gravedad mayor pueden requerir una intervención quirúrgica/endoscópica/percutánea adicional para controlar el foco infeccioso.
Seguimiento
Debe incluir:
- Electrolitos (principalmente en las primeras 48-72 horas).
- Glicemia (objetivo 180-220): La disglicemia puede aumentar el riesgo de infecciones pancreáticas secundarias.
- Monitorear la posibilidad de síndrome compartimental abdominal con mediciones seriadas de la presión intraabdominal en condiciones más graves.
- Los pacientes con pancreatitis aguda moderada o grave con signos de sepsis o deterioro clínico 72 horas después de la presentación inicial deben someterse a una TC abdominal con contraste para evaluar las complicaciones locales.
Enfoque intervencionista
En casos de complicaciones o fracaso en el control infeccioso local, puede estar indicada la intervención.
Idealmente, el abordaje debería iniciar desde el procedimiento menos invasivo al más invasivo (step-up approach).
Idealmente realizado a partir de la cuarta semana de evolución del cuadro, período en el que ya existe una mejor delimitación de la necrosis pancreática.
Intervención endoscópica/percutánea:
- Se puede intentar el drenaje percutáneo/endoscópico con el objetivo de eliminar el líquido que rodea la necrosis pancreática, lo que puede, en algunos casos, controlar la infección sin necesidad de necrectomia.
Intervención quirúrgica: Necrectomía:
- Cirugía en la que se realiza el debridamiento de zonas de necrosis pancreática.
- Pueden ser necesarias varias intervenciones con el uso de peritoneostomía.
- Indicaciones:
- Necrosis pancreática infectada, especialmente en pacientes que no responden a la terapia con antibióticos o que desarrollan inestabilidad hemodinámica.
- La cirugía también puede estar indicada en el contexto de pancreatitis con necrosis estéril:
- Obstrucción intestinal o biliar por efecto de masa 4-8 semanas después del inicio de la pancreatitis aguda.
- Persistencia de dolor abdominal, náuseas, vómitos, anorexia o pérdida de peso 8 semanas después del inicio de la pancreatitis aguda.
- Transección completa del conducto pancreático con persistencia sintomática, asociada a colecciones con necrosis 8 semanas después de pancreatitis aguda.
Especificidades de la pancreatitis aguda biliar
Colangiopancreatografía retrógrada endoscópica (CPRE):
- Idealmente, debe realizarse dentro de las 24 horas posteriores a la hospitalización en presencia de pancreatitis biliar con colangitis bacteriana asociada.
- Otras indicaciones:
- Obstrucción del conducto biliar común con cálculo visible.
- Conducto biliar dilatado o aumento de enzimas hepáticas en ausencia de colangitis.
- No está indicada en pancreatitis biliar aguda sin colangitis, en ausencia de obstrucción del conducto biliar común.
- Puede inducir nuevos cuadros de pancreatitis aguda.
- Se puede realizar una colangiografía por resonancia magnética (colangiorresonancia) y una resonancia magnética del abdomen superior para evaluar la necesidad de una CPRE en mujeres embarazadas y pacientes con anatomía difícil.
Colecistectomía:
- Debe realizarse tras la recuperación completa de la enfermedad aguda en todos los pacientes con pancreatitis biliar, idealmente durante la misma estancia hospitalaria.
- También indicada en pacientes con barro biliar, que se encuentra comúnmente en la ecografía de la vesícula biliar en el 20-40% de los pacientes con pancreatitis aguda sin ninguna otra causa obvia.
- Preferiblemente realizada de forma mínimamente invasiva (videolaparoscópica), asociada a colangiografía intraoperatoria y eventual exploración de las vías biliares ya sea por método quirúrgico o endoscópico asociado, en el mismo momento o posteriormente.
- Siempre en un contexto electivo y no urgente.
Complicaciones
Colecciones líquidas agudas
Definición: Colección de líquidos, sin pared bien definida, que se desarrolla durante la fase inicial de la enfermedad, la mayoría dentro de las 48 horas siguientes al inicio de los síntomas.
Fases iniciales de pancreatitis grave (en menos de cuatro semanas).
Ocurren en 30-50% de los pacientes, en su mayoría peripancreáticos, pero algunos son intrapancreáticos.
Generalmente son estériles y se reabsorben espontáneamente después del tratamiento de la pancreatitis aguda (más de la mitad).
Cuando no resuelven, pueden evolucionar a pseudoquistes o implicar áreas de necrosis.
Pseudoquiste
Definición: Colecciones líquidas en la región peripancreática (que ocasionalmente pueden ser parcial o totalmente intrapancreáticas), que persisten durante más de cuatro semanas, forman una pared visible no epitelizada que atrapa el contenido sin un componente sólido. Su contenido está formado por jugo pancreático rico en enzimas digestivas.
La localización más común es extrapancreática.
Complicaciones:
- La fuga o ruptura produce ascitis pancreática.
- Infección (siendo entonces llamada absceso pancreático).
- Compresión de estructuras adyacentes.
Sólo deben abordarse ante la presencia de síntomas (generalmente observados en pseudoquistes de gran volumen) o signos de infección, realizándose drenaje por vía percutánea o endoscópica.
Colecciones necróticas agudas
Definición: Colecciones con contenido líquido y tejido necrótico antes de las 4 semanas de evolución del cuadro, que pueden provenir del parénquima pancreático o de tejidos adyacentes, se presentan tanto en la región intrapancreática como peripancreática y, en la mayoría de los casos, mantienen comunicación con el conducto pancreático o sus ramificaciones.
Puede ser estéril o estar infectada.
Algunas regiones necróticas pueden evolucionar a pseudoquistes o ser reemplazadas por tejido fibroso.
Necrosis pancreática aislada
Definición: Después de 4 semanas de evolución, las colecciones necróticas desarrollan una pared fibrótica reactiva y gruesa que almacena contenido necrótico en su interior.
Mayor incidencia en la cola y cuerpo del páncreas.
La necrosis estéril no requiere terapia con antibióticos.
Necrosis infectada
Definición: Presencia de gas dentro del contenido necrótico y determinado por el deterioro del estado general y marcadores de laboratorio.
La infección de la necrosis pancreática suele ocurrir alrededor de la segunda o tercera semana de evolución.
En pacientes con necrosis estéril y signos de toxicidad sistémica (fiebre, hipotensión, leucocitosis), se debe considerar repetir la aspiración con aguja fina (PAAF) guiada por TC dentro de 5 a 7 días debido a la posibilidad de una nueva infección. La valores de procalcitonina también puede ayudar en la toma de decisiones sobre el inicio de la terapia con antibióticos.
Idealmente, el material debe recolectarse mediante aspiración con aguja fina (PAAF) guiada por TC para realización Gram y cultivo. Sin embargo, la espera de los resultados no debería retrasar el inicio de la terapia antibiótica empírica.
Según la evolución de estos pacientes y la respuesta a la terapia antibiótica, se considerará la necesidad de intervenciones adicionales para controlar el foco infeccioso, ya sea por métodos menos invasivos (percutáneos o endoscópicos) o mediante cirugía.
Siempre que sea posible, se debe preferir un abordaje endoscópico e idealmente esperar al menos 4 semanas de terapia con antibióticos antes de la intervención. En pacientes inestables, no se debe retrasar la intervención.
Trombosis venosa portoesplenomesentérica
Ocurre en el 50% de los pacientes con pancreatitis necrotizante aguda- Es raro en ausencia de necrosis.
El tratamiento debe centrarse en la pancreatitis subyacente.
Se debe iniciar la anticoagulación si hay extensión del coágulo hacia el sistema porta o la vena mesentérica superior, lo que resulta en descompensación hepática o compromiso de la perfusión intestinal.
En presencia de trombosis de la vena esplénica, existe riesgo de hipertensión portal segmentaria con desarrollo de várices en el fondo gástrico.
Complicaciones sistémicas
Exacerbación de una comorbilidad subyacente: Ej. enfermedad de las arterias coronarias o enfermedad pulmonar crónica.
Síndrome de respuesta inflamatoria sistémica (SIRS):
- Mayor riesgo de falla orgánica (insuficiencia respiratoria aguda, shock e insuficiencia renal).
- Transitorio (hasta 48 horas) en pacientes con pancreatitis moderada a grave o persistente (> 48 horas) en pancreatitis aguda grave.
- La mortalidad es del 25% en pacientes con SIRS persistente, del 8% en pacientes con SIRS transitorio y del 0% en pacientes sin SIRS.
Prescripción hospitalaria
Pancreatitis leve a moderada
Pautas para el prescriptor
- La clasificación de Atlanta define la gravedad de la pancreatitis aguda como leve y moderada:
- Leve: Ausencia de falla orgánica o complicaciones locales/sistémicas.
- Moderado: Falla orgánica (definida por el escore de Marshall modificada) que se resuelve en 48 horas y/o presencia de complicaciones locales/sistémicas.
- Todos los pacientes deben ser hospitalizados. Los casos leves a moderados se siguen en un ambiente de sala y, en general, el tratamiento es clínico.
- El control del dolor es fundamental y se trata según su intensidad, utilizando desde analgésicos no narcóticos hasta derivados opioides, como recomienda la OMS.
- La antibioticoterapia se restringe a los casos de infección, entendiéndose por tal:
- Necrosis pancreática o extrapancreática que evoluciona con deterioro del estado general y/o criterios infecciosos de laboratorio.
- Tomografía abdominal con presencia de gas en zona necrótica.
- La reintroducción de la dieta oral blanda debe iniciarse después de la estabilización hemodinámica y la tolerancia del paciente, independientemente de los valores de lipasa/amilasa.
- Si hay imposibilidad para la alimentación por via oral, se debe dar preferencia a la dieta enteral a través de un sonda nasogástrica.
- La nutrición parenteral debe ser una excepción o un complemento a la nutrición enteral y rara vez está indicada en afecciones leves a moderadas.
- Indicaciones de vía parenteral:
- Mala tolerancia a la vía enteral, ya sea por dolor o empeoramiento de marcadores inflamatorios.
- Incapacidad para lograr el objetivo nutricional con terapia enteral exclusiva dentro de las 48 a 72 horas.
- Contraindicaciones para la vía enteral: Íleo importante o vómitos a repetición.
- Colecciones con efecto masa que impiden un adecuado tránsito gastrointestinal.
- Presencia de absceso pancreático o fístula pancreática.
- Síndrome de hipertensión intraabdominal o presión intraabdominal > 20 mmHg.
- Terapia nutricional:
- Aporte energético cuantificado mediante calorimetría indirecta (gold standard), ecuación de Harris-Benedict o fórmula de bolsillo (25-30 kcal/kg/día), con el 50% representando los carbohidratos.
- Aporte proteico de 1.5-2 g/kg/día (hiperproteico).
- Aporte lipídico < 30-35% del total de calorías (0.8-1.5 g/kg/día). Puede excluirse en caso de hipertrigliceridemia (> 500 mg/dL);
- La mayoría de los pacientes toleran una dieta polimérica. La L-glutamina (0.2 g/kg/día) está indicada como complemento de la dieta parenteral para inmunomodulación en casos seleccionados en los que existe contraindicación/intolerancia a la dieta enteral.
- La suplementación de enzimas pancreáticas no está indicada, excepto en casos de clara insuficiencia pancreática exocrina.
- Considerar medidas de tromboprofilaxis no farmacológica en los cuadros iniciales.
Dieta e hidratación
- Dieta cero en las primeras 48 horas, ajustándose a dieta oral, enteral +/- parenteral según la evolución.
- SF al 0.9% o Ringer lactato 3 mL/kg/hora EV durante 8-12 horas y posteriormente se ajusta según la respuesta clínica.
- Si hipotensión o taquicardia: SF al 0.9% o Ringer lactato 20-30 ml/kg EV en 30 minutos.
Antibioticoterapia empírica
Elija uno de los siguientes esquemas:
- Esquema A: Tratamiento empírico con monoterapia: Elija una de las opciones:
- 1ª linea: Meropenem: 1 g EV cada 8 horas, durante 3-4 semanas.
- 1ª linea: Imipenem cilastatina: 500 mg a 1 g EV cada 8 horas, durante 3-4 semanas.
- Moxifloxacino: 400 mg EV cada 24 horas, durante 3-4 semanas.
- Piperacilina tazobactam: 4.5 g EV cada 6 horas, durante 3-4 semanas.
- Esquema B: Tratamiento empírico con asociación:
- Cefepime: 1-2 g EV cada 8 horas, durante 3-4 semanas + Metronidazol 500 mg EV cada 8 horas durante 3-4 semanas.
- Esquema C: Tratamiento empírico con asociación:
- Ciprofloxacino: 400 mg EV cada 12 horas, durante 3-4 semanas + Metronidazol 500 mg EV cada 8 horas, durante 3-4 semanas.
Profiláctico y sintomático.
- Analgésico y antipirético: Si hay dolor o fiebre ≥ 37,8 °C: Elija una de las siguientes opciones:
- Dipirona: 1-2 g EV hasta cada 4 horas.
- Dipirona: 1 g VO hasta 4 horas.
- Paracetamol: 500-750 mg VO hasta cada 6 horas.
- Nalbufina (opioide): 10 mg EV cada 8 horas.
- Tramadol (opioide): 50-100 mg EV cada 6 horas.
- Morfina (opioide): 2-5 mg EV hasta cada 4 horas. Aumentar la dosis según respuesta.
- Petidina(opioide): 50-150 mg EV hasta cada 4 horas (evitar su uso).
- Antiinflamatorios no esteroides: Elige una de las siguientes opciones:
- Ketoprofeno: 100 mg EV cada 12 horas.
- Ketorolaco: 10-30 mg EV cada 6 horas (dosis máxima diaria: 90 mg).
- Antieméticos: Si hay náuseas y/o vómitos. Elija una de las siguientes opciones:
- Metoclopramida: 10 mg EV cada 8 horas.
- Bromoprida: 10 mg EV cada 8 horas.
- Ondansetron: 4-8 mg EV cada 8 horas.
- Tromboprofilaxis:
- Enoxaparina: 40 mg SC 1 vez al día.
Pancreatitis grave
Pautas para el prescriptor
- Según la clasificación de Atlanta, la pancreatitis grave se define como aquella en la que se produce una falla orgánica (definida por los criterios de Marshall modificados) que dura más de 48 horas.
- Todos los pacientes deben ser hospitalizados. En el caso de la pancreatitis grave, generalmente es necesario el tratamiento en una unidad de cuidados intensivos.
- La velocidad de infusión de cristaloides varía según las diferentes directrices. Sin embargo, es importante mantener al paciente euvolémico.
- El control del dolor es fundamental y se trata según su intensidad, utilizando desde analgésicos no narcóticos hasta derivados opioides, como recomienda la OMS.
- La antibióticoterapia se restringe a los casos de infección, entendiéndose por tal:
- Necrosis pancreática o extrapancreática que evoluciona con deterioro del estado general y/o criterios infecciosos de laboratorio.
- Tomografía abdominal con presencia de gas en zona necrótica.
- La reintroducción de la dieta oral blanda debe iniciarse después de la estabilización hemodinámica y la tolerancia del paciente, independientemente de los valores de lipasa/amilasa.
- Si hay imposibilidad para alimentación por via oral, se debe dar preferencia a la dieta enteral a través de una sonda nasogástrica.
- La nutrición parenteral debe ser una excepción o un complemento a la nutrición enteral y rara vez está indicada en afecciones leves a moderadas.
- Indicaciones de alimentación parenteral:
- Mala tolerancia a la vía enteral, ya sea por dolor o empeoramiento de marcadores inflamatorios
- Incapacidad para lograr el objetivo nutricional con terapia enteral exclusiva dentro de las 48 a 72 horas.
- Contraindicaciones para la vía enteral: Íleo importante o vómitos a repetición.
- Colecciones con efecto masa que impiden un adecuado tránsito gastrointestinal.
- Presencia de absceso pancreático o fístula pancreática.
- Síndrome de hipertensión intraabdominal o presión intraabdominal > 20 mmHg.
- Terapia nutricional:
- Aporte energético cuantificado mediante calorimetría indirecta (gold standard), ecuación de Harris-Benedict o fórmula de bolsillo (25-30 kcal/kg/día), con el 50% representando los carbohidratos.
- Aporte proteico de 1,.5-2 g/kg/día (hiperproteico).
- Aporte lipídico < 30-35% del total de calorías (0.8-1.5 g/kg/día). Puede excluirse en caso de hipertrigliceridemia (> 500 mg/dL).
- La mayoría de los pacientes toleran una dieta polimérica. La L-glutamina (0.2 g/kg/día) está indicada como complemento de la dieta parenteral para inmunomodulación en casos seleccionados en los que existe contraindicación/intolerancia a la dieta enteral.
- La suplementación de enzimas pancreáticas no está indicada excepto en casos de clara insuficiencia pancreática exocrina.
Dieta e hidratación
- Dieta cero en las primeras 48 horas, ajustándose a dieta oral, enteral +/- parenteral según avance (seguir recomendaciones anteriores).
- SF 0.9% o Ringer lactato 3 mL/kg/hora EV durante 8-12 horas y posteriormente se ajusta según la respuesta clínica. Dar preferencia al Ringer lactato si es posible.
- Si hipotensión o taquicardia: SF 0.9% o Ringer lactato 20-30 ml/kg EV en 30 minutos. Dar preferencia al Ringer lactato si es posible.
Tratamiento farmacológico
Elija uno de los siguientes esquemas:
- Esquema A: Tratamiento empírico con monoterapia:
- 1ª linea: Piperacilina tazobactam: 4.5 g EV cada 6 horas, durante 3-4 semanas.
- Esquema B: Tratamiento empírico con asociación:
- Cefepime: 1-2 g EV cada 8 horas, durante 3-4 semanas + Metronidazol: 500 mg EV cada 8 horas, durante 3-4 semanas.
- Esquema C: Tratamiento empírico con asociación:
- Ciprofloxacino: 400 mg EV cada 12 horas, durante 3-4 semanas + Metronidazol: 500 mg EV cada 8 horas, durante 3-4 semanas.
Profiláctico y sintomático.
- Analgésico y antipirético: Si hay dolor o fiebre ≥ 37.8 °C. Elija una de las siguientes opciones:
- Dipirona: 1-2 g EV hasta cada 4 horas.
- Dipirona: 1 g VO hasta cada 4 horas.
- Paracetamol: 500-750 mg VO cada 6 horas.
- Nalbufina (opioide): 10 mg EV cada 8 horas.
- Tramadol (opioide): 50-100 mg EV cada 6 horas.
- Morfina (opioide): 2-5 mg EV hasta cada 4 horas.
- Fentanilo(opioide): 50-100 microgramos IM/EV (dosis de ataque). La analgesia regular se puede realizar con una bomba de infusión a razón de 0.7-10 microgramos/kg/hora.
- Petidina (opioide): 50-150 mg EV hasta cada 4 horas (evitar su uso).
- Antiinflamatorios no esteroides: Elige una de las siguientes opciones:
- Ketoprofeno: 100 mg EV cada 12 horas.
- Ketorolaco: 10-30 mg EV cada 6 horas (dosis máxima diaria: 90 mg).
- Antieméticos: Si hay náuseas y/o vómitos. Elija una de las siguientes opciones:
- Metoclopramida: 10 mg EV cada 8 horas.
- Bromoprida: 10 mg EV cada 8 horas.
- Ondansetron: 4-8 mg EV cada 8 horas.
- Tromboprofilaxis:
- Enoxaparina: 40 mg SC 1 vez al día.
Referencias bibliográficas
Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology. 2013; 13(4 Suppl 2):e1-15.
Freeman ML, Werner J, van Santvoort HC, et al. Interventions for necrotizing pancreatitis: summary of a multidisciplinary consensus conference. Pancreas. 2012; 41(8):1176-94.
Casaer MP, Mesotten D, Hermans G, et al. Early versus late parenteral nutrition in critically ill adults. N Engl J Med. 2011; 365(6):506-17.
Wu BU, Conwell DL. Acute pancreatitis part I: approach to early management. Clin Gastroenterol Hepatol. 2010; 8(5):410-6.
Yasuda T, Ueda T, Takeyama Y, et al. Treatment strategy against infection: clinical outcome of continuous regional arterial infusion, enteral nutrition, and surgery in severe acute pancreatitis. J Gastroenterol. 2007; 42(8):681-9.
Brown A, Baillargeon JD, Hughes MD, et al. Can fluid resuscitation prevent pancreatic necrosis in severe acute pancreatitis? Pancreatology. 2002; 2(2):104-7.
Uhl W, Müller CA, Krähenbühl L, et al. Acute gallstone pancreatitis: timing of laparoscopic cholecystectomy in mild and severe disease. Endosc Surg. 1999; 13(11):1070-6.
Baron TH, DiMaio CJ, Wang AY, et al. American Gastroenterological Association Clinical Practice Update: Management of Pancreatic Necrosis. Gastroenterology. 2020; 158(1):67-75.
de-Madaria E, Buxbaum JL, Maisonneuve P, et al. Aggressive or moderate fluid resuscitation in acute pancreatitis. N Engl J Med. 2022; 387(11):989-1000.
Siriwardena AK, Jegatheeswaran S, Mason JM, et al. A procalcitonin-based algorithm to guide antibiotic use in patients with acute pancreatitis (PROCAP): a single-center, patient-blinded, randomized controlled trial. Lancet Gastroenterol Hepatol. 2022; 7(10):913-921.
Onnekink AM, Boxhoorn L, Timmerhuis HC, et al. Endoscopic versus surgical step-up approach for infected necrotizing pancreatitis (ExTENSION): long-term follow-up of a randomized trial. Gastroenterology. 2022; 163(3):712-722.
Arvanitakis M, Ockenga J, Bezmarevic M, et al. ESPEN guideline on clinical nutrition in acute and chronic pancreatitis. Clin Nutr. 2020; 39(3):612-631.
Lee PJ, Papachristou GI. New insights into acute pancreatitis. Nat Rev Gastroenterol Hepatol. 2019; 16(8):479-496.
Boxhoorn L, Voermans RP, Bouwense SA, et al. Acute pancreatitis. Lancet. 2020; 396(10252):726-734.
Leppäniemi A, Tolonen M, Tarasconi A, et al. 2019 WSES guidelines for the management of severe acute pancreatitis. World J Emer Surg. 2019; 14:27.
Liao WC, Tu TC, Lee KC, et al. Taiwanese consensus recommendations for acute pancreatitis. J Formos Med Assoc. 2020; 119(9):1343-1352.
Crockett SD, Wani S, Gardner TB, et al. American Gastroenterological Association Institute guideline on initial management of acute pancreatitis. Gastroenterology. 2018; 154(4):1096-1101.
Greenberg JA, Hsu J, Bawazeer M, et al. Clinical practice guideline: management of acute pancreatitis. Can J Surg. 2016; 59(2):128-140.
Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis – 2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013; 62(1):102-11.
Tenner S, Baillie J, DeWitt J, et al. American College of Gastroenterology guideline: management of acute pancreatitis. Am J Gastroenterol. 2013; 108(9):1400-15.
Sugerencias y comentarios al correo: contacto@galenbook.com

